
【题目】在一定条件下发生反应:2A(g)+2B(g) ![]() xC(g)+2D(g),在2L密闭容器中,把4molA和2molB混合,2min后达到平衡时生成1.2molC,又测得反应速率VD=0.2mol/(L·min),下列说法正确的是( )
xC(g)+2D(g),在2L密闭容器中,把4molA和2molB混合,2min后达到平衡时生成1.2molC,又测得反应速率VD=0.2mol/(L·min),下列说法正确的是( )
A.A和B的转化率均是20%B.x = 3
C.平衡时A的物质的量为2.8molD.平衡时气体压强比原来减小
【答案】B
【解析】
根据反应速率之比等于化学计量数之比来确定化学计量数x,VD=0.2mol/(Lmin),VC= =0.3mol/(Lmin),则x=3;
=0.3mol/(Lmin),则x=3;
2A(g)+2B(g)![]() 3C(g)+2D(g)
3C(g)+2D(g)
开始(mol) 4 2 0 0
转化(mol) 0.8 0.8 1.2 0.8
平衡(mol) 3.2 1.2 1.2 0.8
结合转化率的概念及物质的量之比等于压强之比来计算。
A、由上述分析可知,A的转化率为![]() ×100%=20%,B的转化率为
×100%=20%,B的转化率为![]() ×100%=40%,故A错误;
×100%=40%,故A错误;
B、由上述分析可知,x=3,故B正确;
C、平衡时A的物质的量为3.2mol,故C错误;
D.同温同容条件下,容器内压强与气体物质的量成正比,该反应正向为气体体积增大的反应,则反应后压强增大,故D错误。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】下列实验过程中,始终无明显现象的是( )
A.NO2通入FeSO4溶液中
B.SO2通入已酸化的Ba(NO3)2溶液中
C.NH3通入AlCl3溶液中
D.CO2通入CaCl2溶液中
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二氧化氯(ClO2)广泛应用于纸浆漂白、杀菌消毒和水净化处理等领域。工业上利用甲醇还原NaClO3的方法制备ClO2,工艺流程如下:
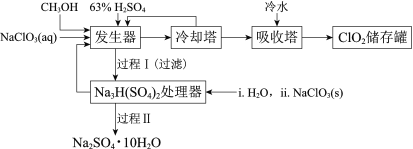
已知:a.发生器中制备ClO2的反应:12NaClO3+8H2SO4+3CH3OH= 12ClO2↑+3HCOOH+4Na3H(SO4)2↓+9H2O
b.相关物质的熔沸点:
物质 | CH3OH | HCOOH | ClO2 |
熔点/℃ | -97 | 9 | -59 |
沸点/℃ | 65 | 101 | 11 |
(1)ClO2可用于纸浆漂白、杀菌消毒是因其具有______性。
(2)冷却塔用于分离ClO2并回收CH3OH,应控制的最佳温度为______(填字母)。
A.0~10℃ B.20~30℃ C.60~70℃
(3)经过程Ⅰ和过程Ⅱ可以获得芒硝(Na2SO4·10H2O)并使部分原料循环利用。
已知:Na2SO4·10H2O和Na2SO4的溶解度曲线如下图:
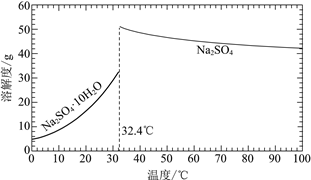
①Na3H(SO4)2处理器中获得芒硝时需加入NaClO3固体,从芒硝溶解平衡的角度解释其原因:______。
②结合Na2SO4·10H2O和Na2SO4的溶解度曲线,过程Ⅱ的操作是:在32.4℃恒温蒸发,______。
③Na3H(SO4)2处理器的滤液中可以循环利用的原料是NaClO3和______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,体积不变的密闭容器中发生反应4NH3(g)+5O2(g) ![]() 4NO(g)+6H2O(g),经2min后达到平衡。NH3的浓度减少了0.6mol·L-1,下列说法正确的是( )
4NO(g)+6H2O(g),经2min后达到平衡。NH3的浓度减少了0.6mol·L-1,下列说法正确的是( )
A.平衡时:5V正(O2)=4V逆(NO)
B.2min末的反应速率,用NO表示是0.3 mol·L-1·min-1
C.由混合气体的密度不再改变可判定达到平衡
D.由混合气体的压强不再改变可判定达到平衡
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酸锶(SrSO4)在水中的沉淀溶解平衡曲线如下.下列说法正确的是( )
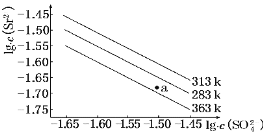
A.温度一定时,Ksp(SrSO4)随c(SO42-)的增大而减小
B.三个不同温度中,313K时Ksp(SrSO4)最小
C.283K时,图中a点对应的溶液是不饱和溶液
D.283K下的SrSO4饱和溶液升温到363K后变为不饱和溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锂离子电池又称为“摇摆电池”,广泛使用于电动自行车等,其充放电过程就是锂离子的嵌入和脱嵌过程(习惯上正极用嵌入或脱嵌表示,负极用插入或脱插表示),即充放电过程就是锂离子在正、负极间往返运动而形成电流。其装置结构简图如图所示(电解液为溶有LiPF6的碳酸酯类溶剂,隔膜为仅有锂离子能通过的高分子膜),工作原理为C6Li+Li(1-x)MO2![]() LiMO2+C6Li(1-x)(M代表过渡元素),则下列说法错误的是( )
LiMO2+C6Li(1-x)(M代表过渡元素),则下列说法错误的是( )
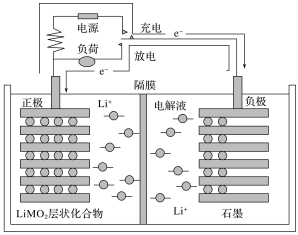
A.电池放电时,正极为石墨
B.锂离子电池的优点是质量小,电容量大,可重复多次使用
C.电池充电时阳极的反应为LiMO2-xe-=Li(1-x)MO2+xLi+
D.锂离子电池的电解液不能是水溶液,因为锂是活泼金属,能与水反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,下列各组离子在指定溶液能大量共存的是
A.pH=1的溶液中:Fe2+、NO3-、SO42-、Na+
B.由水电离的c(H+)=1×10-14mol·L-1的溶液中:Ca2+、K+、Cl-、HCO3-
C.![]() =1012的溶液中:NH4+、Al3+、NO3-、Cl-
=1012的溶液中:NH4+、Al3+、NO3-、Cl-
D.c(Fe3+)=0.1 mol·L-1的溶液中:K+、ClO-、SO42-、SCN-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲、乙两烧杯中各盛有100mL1.5mol·L-1的盐酸和氢氧化钠溶液,向两烧杯中分别加入2.7g的铝粉,计算反应结束后生成的气体的体积比是( )
A.1:1B.1:2C.2:1D.3:2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】1.52 g铜镁合金完全溶解于50 mL密度为1.40 g·mL-1、质量分数为63%的浓硝酸中,得到NO和N2O4的混合气体1120mL (标推状况),向反应后的溶液中加入1.0mol·L-1NaOH溶液,当金属离子全部沉淀时,得到2.54 g沉淀。下列说法不正确的是
A. 该浓硝酸中HNO3的物质的量浓度是14.0 mol·L-1
B. 该合金中铜与镁的物质的量之比是2:1
C. NO2和N2O4的混合气体中,NO的体积分数是20%
D. 得到2.54 g沉淀时,加入NaOH溶液的体积是600mL
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com