
【题目】已知25 ℃时,HCN的电离常数Ka=6.2×10-10 mol·L-1,CH3COOH的电离常数Ka=1.7×10-5 mol·L-1。请根据以下四个图像回答问题。
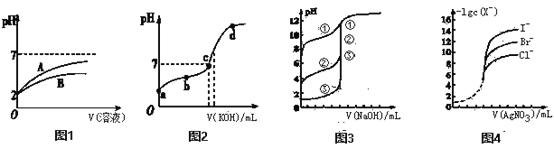
(1)25 ℃时,体积均为100 mL、pH=2的CH3COOH溶液和HCN溶液,加水稀释过程中溶液的pH变化与溶液体积的关系如图1所示,则表示CH3COOH溶液的pH变化趋势的曲线是:______(填“A”或“B”);相同条件下,NaCN溶液的pH________(填 “>”“=”或“<”)CH3COONa溶液的pH。将0.2 mol·L-1HCN溶液与0.1mol·L-1NaOH溶液等体积混合,则溶液中离子浓度由大到小顺序为______________。(提示:可根据平衡常数大小关系判断反应程度大小)
(2)如图2所示,25 ℃时向20 mL 0.01 mol·L-1CH3COOH溶液中逐滴加入0.01 mol·L-1 KOH溶液,其pH变化曲线如图所示(忽略温度变化)。下列说法正确的是_______
A.a点溶液中c(H+)为1×10-4 mol·L-1
B.a、b、c、d四点中水的电离程度最大的是c点
C.滴定过程中宜选用酚酞做指示剂
D.b点溶液中离子浓度大小顺序一定为c(CH3COO-)> c(H+)>c(K+)>c(OH-)
(3)如图3表示用相同的NaOH溶液分别滴定浓度相同的三种一元酸,由图可知酸性最强的是_____(填“①”“②””或“③” )。
(4)如图4表示相同浓度的AgNO3标准溶液分别滴定浓度相同的含Cl-、Br- 及I-的混合溶液,由图可确定首先沉淀的离子是________。已知25 ℃时Ksp(AgCl)=2×10-10,在1L 0.1mol/L的NaCl溶液中加入1L 0.2mol/L的AgNO3溶液,充分反应后溶液中c(Cl-)=_________(假设混合溶液的体积为2L)
【答案】A > c(Na+)>c(CN-)>c(OH-)>c(H+) BC ③ I- 4.0×10-9
【解析】
(1)根据电离平衡常数进行判断;混合溶液先反应,根据产物和剩余反应物在进行判断;
(2)A.根据醋酸电离常数计算;
B.酸或碱抑制水电离,a和b点溶液都呈酸性,所以抑制水电离,c点呈中性,d点碱过量抑制水的电离,c点水的电离程度最大;
C.氢氧化钾滴定醋酸恰好反应生成醋酸钾溶液呈碱性,应选择酚酞试液指示反应终点;
D.b点溶液呈酸性,溶液中的溶质是醋酸钾和醋酸,当醋酸钾的物质的量大于或醋酸的物质的量,则溶液中离子浓度大小顺序是c(CH3COO-)>c(K+)>c(H+)>c(OH-),当醋酸钾的物质的量远远小于醋酸的物质的量时,溶液中离子浓度大小顺序是c(CH3COO-)>c(H+)>c(K+)>c(OH-);
(3)由图可知,浓度相同的三种一元酸,滴定前pH值③<②<①,故③的酸性最强;
(4)由图可看出,碘化银的Ksp最小,首先沉淀的离子是I-;再根据Ksp计算;
(1)pH相等的酸中,加水稀释促进弱酸电离,稀释相同的倍数,pH变化大的为强酸,小的为弱酸,HCN的电离平衡常数小于醋酸,所以HCN的酸性小于醋酸, CH3COOH溶液的pH变化趋势较大,为A线,且因为HCN的酸性小于醋酸,CN-的水解能力强于CH3COO-,故NaCN溶液的pH>CH3COONa溶液的pH。反应后生成等浓度的HCN与NaCN溶液,CN-的水解能力强于电离能力溶液显碱性,则溶液中离子浓度由大到小顺序为c(Na+)>c(CN-)>c(OH-)>c(H+),故答案为:A,>,c(Na+)>c(CN-)>c(OH-)>c(H+);
(2)A.根据醋酸电离常数可知:![]() =1.7×10-5,计算得c(H+)=
=1.7×10-5,计算得c(H+)=![]() ×10-4mol/L,故A不正确;
×10-4mol/L,故A不正确;
B.酸或碱抑制水电离,a和b点溶液都呈酸性,所以抑制水电离,c点呈中性,d点碱过量抑制水的电离, c点水的电离程度最大,故B正确;
C.氢氧化钾滴定醋酸恰好反应生成醋酸钾溶液呈碱性,应选择酚酞试液指示反应终点;故C正确;
D.b点溶液呈酸性,溶液中的溶质是醋酸钾和醋酸,当醋酸钾的物质的量大于或醋酸的物质的量,则溶液中离子浓度大小顺序是c(CH3COO-)>c(K+)>c(H+)>c(OH-),当醋酸钾的物质的量远远小于醋酸的物质的量时,溶液中离子浓度大小顺序是c(CH3COO-)>c(H+)>c(K+)>c(OH-),故D不正确;
正确答案:BC;
(3)由图可知,浓度相同的三种一元酸,滴定前pH值③<②<①,故③的酸性最强;
正确答案:③;
(4)由图可看出,如相同体积的硝酸银溶液后,I-浓度最小,因此碘化银的Ksp最小,首先沉淀的离子是I-;
设充分反应后溶液中c(Cl-)=xmol/L:银离子过量,过量银离子浓度为0.1mol÷2L=0.05mol/L,根据Ksp(AgCl)=c(Ag+)×c(Cl-)得出c(Cl-)=![]() =4.0×10-9mol/L;正确答案: I- ,4.0×10-9。
=4.0×10-9mol/L;正确答案: I- ,4.0×10-9。


 亮点激活精编提优100分大试卷系列答案
亮点激活精编提优100分大试卷系列答案科目:高中化学 来源: 题型:
【题目】某种降血压药物硝苯地平的合成路线如下:

已知:
 +R”’CHO
+R”’CHO
(1)A 的结构简式是 ___________。
(2)B与新制Cu(OH)2 反应的化学方程式是 ______________。
(3)H → I的反应类型是 _______________。
(4)试剂a 是 _______________。
(5)J→K的化学反应方程式是 ___________。
(6)F 有多种同分异构体,写出满足下列条件的一种同分异构体的结构简式__________。
①分子中含有酯基,且存在顺反异构
②能与金属Na单质反应,且能发生银镜反应
(7)1 mol 硝苯地平最多可与__________mol NaOH溶液发生水解反应。
(8)已知 D![]() E→F +CH3OH,E的结构简式是_______________。
E→F +CH3OH,E的结构简式是_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】葡萄是一种常见水果,可以生食或制作葡萄干,除此之外,葡萄还可用于酿酒。
(1)检验葡萄汁含有葡萄糖的方法是:向其中加碱调至碱性,再加入新制的Cu(OH)2并加热,其现象是________。
(2)葡萄在酿酒过程中,葡萄糖转化为酒精的过程如下,补充完成下列化学方程式:C6H12O6(葡萄糖)![]() 2_________+ 2 C2H5OH
2_________+ 2 C2H5OH
(3)葡萄酒密封储存过程中会生成有香味的酯类,酯类也可以通过化学实验来制备,实验室可用如图所示装置制备乙酸乙酯:

①试管a中生成乙酸乙酯的化学方程式是__________。
②试管b中盛放的试剂是饱和____________溶液。
③实验开始时,试管b中的导管不伸入液面下的原因是________。
④若要分离出试管b中的乙酸乙酯,需要用到的仪器是_______(填字母)。
A.普通漏斗 B.分液漏斗 C.长颈漏斗
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室合成乙酸乙酯的步骤如下:在圆底烧瓶内加入乙醇、浓硫酸和乙酸,瓶口竖直安装通有冷却水的冷凝管(使反应混合物的蒸气冷凝为液体流回烧瓶内),加热回流一段时间后换成蒸馏装置进行蒸馏(如下图所示),得到含有乙醇、乙酸和水的乙酸乙酯粗产品。请回答下列问题:
(已知:乙醇、乙酸、乙酸乙酯的沸点依次是78.4℃、118℃、77.1℃)

(1)在烧瓶中除了加入乙醇、浓硫酸和乙酸外,还应放入_____,其目的是________________________。
(2)在烧瓶中加入一定比例的乙醇和浓硫酸的混合液的方法是:______________________。
(3)在该实验中,若用1 mol乙醇和1 mol乙酸在浓硫酸作用下加热,充分反应,能否生成1 mol乙酸乙酯,为什么?__________________________________________。
(4)现拟分离含乙酸、乙醇和水的乙酸乙酯粗产品,下图是分离操作步骤流程图。请在图中圆括号内填入适当的试剂,在方括号内填入适当的分离方法。
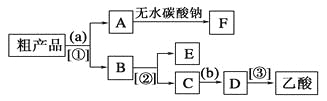
试剂a是__________,试剂b是__________;分离方法①是________,分离方法②是________,分离方法③是______。
(5)在得到的A中加入无水碳酸钠粉末,振荡,目的是________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室配制480mL 0.1mol/L的CuCl2溶液,实际操作步骤有:
①在天平上称量一定量的CuCl2,放入烧杯,加水溶解;
②把制得的溶液小心地注入容量瓶中;
③继续向容量瓶中加水至距刻度1~2厘米处,改用胶头滴管加水至刻度;
④用少量水洗涤烧杯和玻璃棒2~3次,每次将洗涤液转入容量瓶,并摇匀;
⑤将容量瓶塞塞紧,充分摇匀。填写下列空白:
(1)称量CuCl2的总质量是______;
(2)操作步骤的正确顺序是(填序号)________;
(3)本实验使用到的玻璃仪器有烧杯、玻璃棒、胶头滴管、______;
(4)若没有进行④操作,会使结果(填偏高、偏低或无影响,下同)_____;
(5)若用天平称固体时,砝码上沾有油污,则所配制的溶液浓度将_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】汽车尾气中CO、氮氧化物(NOx) 严重影响人们的生活和健康,化学工作者对氮氧化物的处理做了广泛而深人的研究。
I.利用甲烷还原NOX
①CH4(g)+4NO2(g)=4NO(g) +CO2(g)+2H2O(g) △H1=-574kJ/mol ;
②CH4 (g)+4NO(g)=2N2(g) +CO2(g)+2H2O(g) △H2=-1160 kJ/mol 。
(1)甲烷直接将NO2 还原为N2的热化学方程式为______________________________。
(2)在恒容(2L)密闭容器中充入1molCH4和2moINO2进行(1)中反应,CH4的平衡转化率φ。(CH4)与温度和压强的关系如图甲所示。
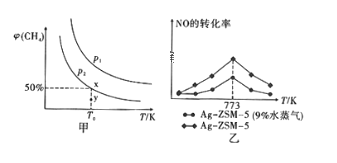
①若容器中的压强为p2,y 点; v 正________V逆(填“大于"“等于“或“小于”)。
②图中压强大小P1_______ P2
③X 点对应温度下反应的平衡常数K=______________ 。
II.某研究小组以Ag-ZSM-5为催化剂模拟汽车尾气的处理,实现NO和CO反应转化为无毒气体。同时利用反应放出的热量预热NO 和CO。实验测得NO的转化率随温度的变化如图乙所示。
(1)高于773K,NO的转化率降低的可能原因是_________________。
(2)为提高汽车尾气中NO的转化率,除了改变温度、压强外,还可以采取的措施有_________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】能正确解释下列反应原理的离子方程式是( )
A.用明矾作净水剂:Al3++3H2O![]() Al(OH)3↓+3H+
Al(OH)3↓+3H+
B.氯气通入水中,溶液呈酸性:Cl2 + H2O![]() 2H+ + Cl- + ClO-
2H+ + Cl- + ClO-
C.酚酞滴入碳酸钠溶液中,溶液变红:CO32- + 2H2O![]() H2CO3+ 2OH-
H2CO3+ 2OH-
D.用碳酸钠溶液浸泡锅炉水垢:CaSO4 + CO32-=CaCO3 + SO42-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是一个化学过程的示意图,回答下列问题:
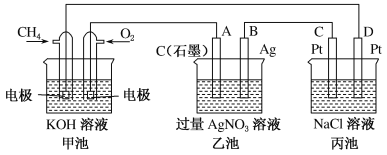
(1)甲池是_____装置,乙装置中电极A的名称是______。
(2)甲装置中通入CH4的电极反应式为_____,乙装置中电极B(Ag)的电极反应式为_____,丙装置中D极的产物是_____(写化学式)。
(3)一段时间,当丙池中产生112 mL(标准状况下)气体时,均匀搅拌丙池,所得溶液在25℃时的pH=_____。(已知:NaCl溶液足量,电解后溶液体积为500 mL)。若要使丙池恢复电解前的状态,应向丙池中通入_______(写名称)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据核外电子的排布特点推断元素的性质:
(1)A元素基态原子的最外层有3个未成对电子,次外层有2个电子,其基态原子的电子排布图为_____,在周期表中位于___区。
(2) B元素基态原子的M层全充满,N层没有成对电子且只有一个未成对电子,B的基态原子的价层电子排布式为_______。
(3)请利用电子排布的相关知识稳定性:Fe3+______Fe2+(填>或< ),原因___________,第一电离能:Mg____Al(填>或< )原因__________。
(4) 有以下物质:①H2 ②N2 ③CO2 ④N2H4⑤H2O2 ⑥HCN(H—C≡N);只有σ键的是______;既有σ键又有π键的是__________;含有由两个原子的s轨道重叠形成的σ键的是_____;含有由一个原子的s轨道与另一个原子的p轨道重叠形成的σ键的是______;
(5) 通过 (3)的解答,请归纳基态原子核外电子排布除了符合构造原理外,泡利原理、洪特规则外,还有哪些结构稳定__________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com