
【题目】将一定量的铜粉加入到0.5 L 0.3 mol·L-1 Fe2(SO4)3和0.1 mol·L-1 H2SO4的混合溶液中,铜粉完全溶解后,得到溶液X。下列说法正确的是( )
A.溶液X中Cu2+与Fe2+的物质的量之比为2∶1
B.向溶液X中加入足量铁粉,充分反应后,铁粉质量减少11.2 g
C.向溶液X中滴加KSCN溶液,未变红色,则加入铜粉质量为12.8 g
D.向溶液X中加入0.18 L 5 mol·L-1 NaOH溶液可使溶液中的金属离子完全沉淀
【答案】B
【解析】
0.5L0.3molL1Fe2(SO4)3和0.1molL1H2SO4的混合溶液中,n((Fe3+)=cV=0.5L×2×0.3 mol·L-1 =0.3mol,n((H+)=cV=0.5L×2×0.1 mol·L-1 =0.1mol,n(SO42)= ![]() n((Fe3+)+
n((Fe3+)+![]() n((H+)=0.5mol,发生Cu+2Fe3+═Cu2++2Fe2+,所得溶液中Fe3+、Cu2+的物质的量与铜粉的量有关。
n((H+)=0.5mol,发生Cu+2Fe3+═Cu2++2Fe2+,所得溶液中Fe3+、Cu2+的物质的量与铜粉的量有关。
A. 发生Cu+2Fe3+═Cu2++2Fe2+,所得溶液中Cu2+与Fe2+的物质的量之比为1:2,故A错误;
B.向溶液X中加入足量铁粉,因铁离子的氧化性强于铜,所以铁先与三价铁反应,后置换出铜,最后与酸反应,因铁足量,相当于铁和原来的铁离子、氢离子反应,与加入的铜的量的多少无关,0.5L0.3molL1Fe2(SO4)3和0.1molL1H2SO4的混合溶液中,n(Fe3+)=cV=0.3molL1×0.5L×2=0.3mol,n((H+)=0.1mol,所以,发生Fe+2Fe3+═3Fe2+,消耗n(Fe)=0.15mol,发生Fe+2H+=Fe2++H2↑,消耗n(Fe)=0.05mol,总共消耗n(Fe)=0.15mol+0.05mol=0.2mol,充分反应后,铁粉质量减少m=nM=0.2mol×56g/mol=11.2g,故B正确;
C.混合溶液中,n((Fe3+)=cV=0.3mol,发生Cu+2Fe3+═Cu2++2Fe2+,未变红色,则三价铁完全反应,消耗n(Cu)=0.15mol,m=nM=0.15mol×64g/mol=9.6g,故C错误;
D.铜完全溶解时,溶液中可能存在的Fe2+、Cu2+、H+三种离子,或铜完全溶解时,溶液中的Fe3+、Fe2+、Cu2+、H+四种离子,沉淀完全,溶质为硫酸钠(Na2SO4),n(SO42) =0.5mol,所以n(Na+)=1mol,需NaOH的物质的量为1mol,加入0.18L5molL1NaOH溶液,氢氧化钠量为0.18 L×5 molL1=0.9mol,则氢氧化钠的量不足,不能完全沉淀,故D错误;
答案选B。


科目:高中化学 来源: 题型:
【题目】一定量的盐酸跟过量的铁粉反应时,为了减缓反应速度,且不影响生成氢气的总量,可向盐酸中加入适量的( )
①NaOH固体 ②H2O ③HCl气体 ④CH3COONa固体 ⑤NaNO3固体 ⑥KCl溶液
A.②④⑥B.①②C.②③⑤D.②④⑤⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列溶液中微粒浓度关系一定正确的是( )
A.氨水与氯化铵的pH =7的混合溶液中:![]()
B.pH =2的一元酸和pH =12的一元强碱等体积混合:![]()
C.0.1molL-1的硫酸铵溶液中:![]()
D.0.1molL-1的硫化钠溶液中:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,下列溶液的离子浓度关系式正确的是
A. pH=5的H2S溶液中,c(H+)= c(HS-)=1×10—5mol·L—1
B. pH=a的氨水溶液,稀释10倍后,其pH=b,则a=b+1
C. pH=2的H2C2O4溶液与pH=12的NaOH溶液任意比例混合:c(Na+)+ c(H+)= c(OH-)+c( HC2O4-)
D. pH相同的①CH3COO Na②NaHCO3③NaClO三种溶液的c(Na+):①>②>③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是![]()
①含有大量![]() 的溶液中,
的溶液中,![]() 、
、![]() 、
、![]() 、
、![]() 可以大量共存
可以大量共存
②![]() 的
的![]() 溶液中,
溶液中,![]() 、
、![]() 、
、![]() 、
、![]() 可以大量共存
可以大量共存
③向![]() 溶液中加入过量的稀氨水,发生反应:
溶液中加入过量的稀氨水,发生反应:![]()
④加入铝粉能放出![]() 的溶液中,
的溶液中,![]() 、
、![]() 、
、![]() 、
、![]() 一定能够大量共存
一定能够大量共存
⑤用NaOH溶液除去铝条表面的氧化膜:![]()
⑥依据铝热反应原理,能发生反应
⑦向明矾溶液中加入过量![]() 溶液,发生反应:
溶液,发生反应:![]()
⑧常温下,铝可溶于过量浓硝酸,也可溶于过量NaOH溶液
A.⑤⑦B.②③⑤C.④⑤⑥D.②⑦⑧
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究小组探究在加热条件下FeSO4分解的气体产物及相关性质。已知:SO2的沸点为-10 ℃、SO3的沸点为44.8 ℃。
用如图所示装置设计实验,验证分解FeSO4生成的气态产物。
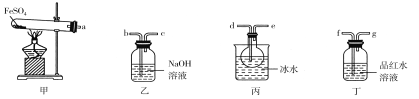
(1)实验前必须进行的操作是________。
(2)按气流方向连接各仪器,用字母表示接口的连接顺序:a→________。
(3)若观察到装置甲中固体变为红棕色,装置丙中有无色液体产生,装置丁中溶液变成无色,则FeSO4分解的化学方程式为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】科学家预言,燃料电池将是21世纪获得电能的重要途径。近几年开发的甲醇燃料电池是采用铂作电极催化剂,电池中的质子交换膜只允许质子(就是H+)和水分子通过。其工作原理的示意图如下,请回答下列问题:

(1)该装置的能量转化形式为________。
(2)Pt(a)电极是电池________(填“正”或“负”)极;
(3)电解液中的H+向_____(填“a”或“b”)极移动;
(4)如果该电池工作时消耗1 mol CH3OH,则电路中通过___ mol电子。
(5)比起直接燃烧燃料产生电力,使用燃料电池有许多优点,其中主要有两点:首先是燃料电池的能量转化率高,其次是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】影响化学反应速率的因素很多,某校化学小组用实验的方法进行探究。
实验一:他们只利用Cu、Fe、Mg和不同浓度的硫酸(0.5 mol·L-1、2 mol·L-1、18.4 mol·L-1)设计实验方案来研究影响化学反应速率的因素。甲同学的实验报告如下表:
实验步骤 | 现象 | 结论 |
①分别取等体积的2 mol·L-1的硫酸于试管中 | 反应速率Mg>Fe,Cu不反应 | 金属的性质越活泼,反应速率越快 |
②____________ | 反应物浓度越大,反应速率越快 |
(1)甲同学表中实验步骤②为_________________________________________。
(2)甲同学的实验目的是_____________;要得出正确的实验结论,还需控制的实验条件是____________。乙同学为了更精确地研究浓度对反应速率的影响,利用如图所示装置进行定量实验。

(3)乙同学在实验中应该测定的数据是___________________________________________________。
(4)乙同学完成该实验应选用的实验药品是________,该实验中不选用某浓度的硫酸,理由是___________。
实验二:已知 2KMnO4+5H2C2O4+3H2SO4===K2SO4+2MnSO4+8H2O+10CO2↑,在高锰酸钾酸性溶液和草酸溶液反应时,发现开始一段时间,反应速率较慢,溶液褪色不明显;但不久突然褪色,反应速率明显加快。
(5)针对上述实验现象,丙同学认为KMnO4与H2C2O4反应放热,导致溶液温度升高,反应速率加快。从影响化学反应速率的因素看,你猜想还可能是______________的影响。
(6)若用实验证明你的猜想,除高锰酸钾酸性溶液、草酸溶液外,还需要选择的试剂最合理的是________(填字母)。
A.硫酸钾 B.硫酸锰 C.二氯化锰 D.水
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】【物质结构与性质】磷化硼(BP)是一种受关注的耐磨涂层材料,可作为钛等金属表面的保护薄膜。
(1)三溴化硼和三溴化磷混合物在高温条件下与H2反应可以制得BP。
①上述反应的化学方程式为________________________;
②磷原子中存在_____种不同能量的电子,电子占据的最高能层符号为_______。
③常温下,三溴化磷是淡黄色发烟液体,可溶于丙酮、四氯化碳中,该物质属于______晶体(填晶体类型)。
(2)已知磷酸是中强酸,硼酸是弱酸;pKa= -lgKa。
①有机酸的酸性强弱受邻近碳上取代原子的影响,如酸性:BrCH2COOH >CH3COOH。据此推测,pKa:AtCH2COOH____ClCH2COOH(填“>”、“<”、“=”)
②磷酸是三元酸,写出两个与PO43-具有相同空间构型和键合形式的分子或离子_________________。
③硼酸是一元酸,它在水中表现出来的弱酸性,并不是自身电离出氢离子所致,而是水分子与B(OH)3结合,生成一个酸根离子,该阴离子的结构式为:_________(若存在配位键,请用箭头标出)。
(3)高温陶瓷材料Si3N4的成键方式如图1所示,结构中N—Si—N的键角比Si—N—Si的键角大,其原因是_____________________________________。
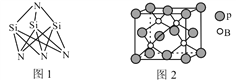
(4)磷化硼的晶体结构如图2所示。晶胞中P原子的堆积方式为________(填“简单立方”、“体心立方”或“面心立方最密”)堆积。若该晶体中最邻近的两个P原子之间的距离为a nm,则晶体密度为__________g·cm-3(只需列出计算式)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com