
【题目】某研究小组探究在加热条件下FeSO4分解的气体产物及相关性质。已知:SO2的沸点为-10 ℃、SO3的沸点为44.8 ℃。
用如图所示装置设计实验,验证分解FeSO4生成的气态产物。
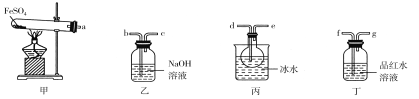
(1)实验前必须进行的操作是________。
(2)按气流方向连接各仪器,用字母表示接口的连接顺序:a→________。
(3)若观察到装置甲中固体变为红棕色,装置丙中有无色液体产生,装置丁中溶液变成无色,则FeSO4分解的化学方程式为________。
【答案】检查装置气密性 d→e→f→g→b→c 2FeSO4 ![]() Fe2O3+SO2↑+SO3↑
Fe2O3+SO2↑+SO3↑
【解析】
甲装置为FeSO4在高温下分解生成Fe2O3、SO3和SO2的装置,三氧化硫易和水反应生成硫酸,三氧化硫熔点高,故先用(丙装置)冰水混合物使三氧化硫液化,丁中装有品红溶液,检验二氧化硫,二氧化硫有毒,会污染空气,故用(乙装置)氢氧化钠溶液吸收。
(1)连接好装置后必须进行检查装置气密性,确保装置气密性良好,避免SO3和SO2泄漏污染空气以及影响实验的进行;
(2)甲装置为FeSO4在高温下分解装置,乙装置为吸收尾气装置,丙装置冰水混合物使三氧化硫液化,丁装置用品红溶液检验二氧化硫,据此分析选择连接口;
(3)甲中固体变为红棕色,说明有Fe2O3生成;若观察到装置丙中有无色液体产生为水,装置丁中溶液变成无色有二氧化硫产生,FeSO4分解生成Fe2O3、SO3和SO2。
(1)该实验装置中连接了多个仪器,且SO3和SO2是有毒气体,为避免SO3和SO2泄漏,污染空气、浪费试剂,且保证实验的顺利进行,所以在实验前需要检验装置气密性,
故答案为:检查装置气密性;
(2)甲装置为FeSO4在高温下分解生成Fe2O3、SO3和SO2的装置,三氧化硫易和水反应生成硫酸,三氧化硫熔点高,故先用冰水混合物使三氧化硫液化,即a和d相连,检验二氧化硫用品红溶液,丁中装有品红溶液,即e和f相连,二氧化硫有毒,会污染空气,故用氢氧化钠溶液吸收,即g和b相连,所以按气流方向连接各仪器连接顺序为a→d→e→f→g→b→c,
故答案为:d→e→f→g→b→c;
(3)甲中固体变为红棕色,说明有Fe2O3生成,若观察到装置丙中有无色液体产生为水,装置丁中溶液变成无色有二氧化硫产生,FeSO4分解生成Fe2O3、SO3和SO2,反应的方程式为:2FeSO4![]() Fe2O3+SO2↑+SO3↑,
Fe2O3+SO2↑+SO3↑,
故答案为:2FeSO4 ![]() Fe2O3+SO2↑+SO3↑;
Fe2O3+SO2↑+SO3↑;


 千里马走向假期期末仿真试卷寒假系列答案
千里马走向假期期末仿真试卷寒假系列答案科目:高中化学 来源: 题型:
【题目】根据要求完成下列各题。
(1)25℃时,向AgCl的悬浊液中加入KI固体,有黄色沉淀生成。说明Ksp(AgCl)___Ksp(AgI)(填“<”、“>”或“=”下同)。
(2)已知H+(aq)+OH-(aq)=H2O(l) ΔH=-57.3kJ·mol-。若浓硫酸与氢氧化钠溶液发生中和反应生成1mol水,则ΔH的数值___57.3kJ·mol-;若稀盐酸与氨水发生中和反应生成1mol水,则ΔH的数值___57.3kJ·mol-1。
(3)在化学反应里只有活化分子才可能发生化学反应,使普通分子变成活化分子所需提供的最低限度的能量叫活化能。根据如图回答问题。
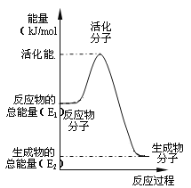
①图中所示反应是___(填“吸热”或“放热”)反应,该反应___(填“需要”或“不需要”)加热,该反应的△H=___(用含E1、E2的代数式表示)。
②已知热化学方程式:H2(g)+![]() O2(g)=H2O(g) △H=-241.8kJ·mol-1,该反应的活化能为167.2kJ·mol-1,则其逆反应的活化能为___。
O2(g)=H2O(g) △H=-241.8kJ·mol-1,该反应的活化能为167.2kJ·mol-1,则其逆反应的活化能为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应N2(g)+3H2(g)![]() 2NH3 (g) △H<0,在某一时间段中反应速率与反应过程的曲线关系如图,t1、t3、t4时刻外界条件有所改变。下列说法正确的是( )
2NH3 (g) △H<0,在某一时间段中反应速率与反应过程的曲线关系如图,t1、t3、t4时刻外界条件有所改变。下列说法正确的是( )

A. t5~t6时氨气的体积分数最大 B. t3时升高了温度
C. t1时加入催化剂 D. t4时减小压强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求回答下列问题:
(1)已知拆开![]() 键、
键、![]() 键、
键、![]() 键分别需要吸收的能量为
键分别需要吸收的能量为![]() 、
、![]() 、
、![]() 。则由
。则由![]() 和
和![]() 反应生成1molHCl需要_______
反应生成1molHCl需要_______![]() 填“放出”或“吸收”
填“放出”或“吸收”![]() _________
_________![]() 的热量。
的热量。
(2)将等物质的量的A和B,混合于2 L的密闭容器中,发生如下反应 ![]() 。2min后,测得D的浓度为
。2min后,测得D的浓度为![]() mol/L ,
mol/L ,![]() ,C的反应速率是
,C的反应速率是![]() mol/(L·min)。则:
mol/(L·min)。则:
①x的值是__________;
②B的平均反应速率是____________;
③A在2min末的浓度是________________;
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将一定量的铜粉加入到0.5 L 0.3 mol·L-1 Fe2(SO4)3和0.1 mol·L-1 H2SO4的混合溶液中,铜粉完全溶解后,得到溶液X。下列说法正确的是( )
A.溶液X中Cu2+与Fe2+的物质的量之比为2∶1
B.向溶液X中加入足量铁粉,充分反应后,铁粉质量减少11.2 g
C.向溶液X中滴加KSCN溶液,未变红色,则加入铜粉质量为12.8 g
D.向溶液X中加入0.18 L 5 mol·L-1 NaOH溶液可使溶液中的金属离子完全沉淀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列对化学平衡移动的分析中,不正确的是
①已达平衡的反应C(s)+H2O(g)![]() CO(g)+H2(g),当增加反应物物质的量时,平衡一定向正反应方向移动
CO(g)+H2(g),当增加反应物物质的量时,平衡一定向正反应方向移动
②已达平衡的反应N2(g)+3H2(g)![]() 2NH3(g),当增大N2的浓度时,平衡向正反应方向移动,N2的转化率一定升高
2NH3(g),当增大N2的浓度时,平衡向正反应方向移动,N2的转化率一定升高
③2.0molPCl3和1.0molCl2充入恒容的密闭容器中,发生反应:PCl3(g)+ Cl2(g)![]() PCl5(g)达平衡时,PCl5为0.4mol,如果此时移走1.0 molPCl3 和0.50 molCl2,在相同温度下再达平衡时PCl5的物质的量应大于0.20mol而小于0.40mol
PCl5(g)达平衡时,PCl5为0.4mol,如果此时移走1.0 molPCl3 和0.50 molCl2,在相同温度下再达平衡时PCl5的物质的量应大于0.20mol而小于0.40mol
④有气体参加的反应达平衡时,在恒压反应器中充入稀有气体,平衡不会发生移动
A.①④B.①②③C.②③④D.①②③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在密闭容器中存在如下反应:A (g)+3B(g) ![]() 2C(g);△H<0,某研究小组研究了只改变某一条件对上述反应的影响,并根据实验数据作出下列关系图:
2C(g);△H<0,某研究小组研究了只改变某一条件对上述反应的影响,并根据实验数据作出下列关系图:
![]()

下列判断一定错误的是
A.图Ⅰ研究的是压强对反应的影响,且乙的压强较高
B.图Ⅱ研究的是压强对反应的影响,且甲的压强较高
C.图Ⅱ研究的是温度对反应的影响,且甲的温度较高
D.图Ⅲ研究的是不同催化剂对反应的影响,且甲使用催化剂的效率较高
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】广东省有着丰富的海洋资源。海水提取食盐和Br2以后的盐卤可以用来制备纯净的MgCl2或MgO。盐卤中含有Mg2+、Cl-,还含有少量Na+、Fe2+、Fe3+和CO(NH2)2等.制备流程如图所示:
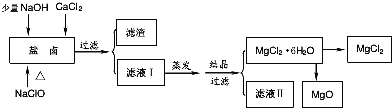
(1)滤渣的成分是____________(填化学式);滤液Ⅱ中所含的主要杂质离子是________(写离子符号)。
(2)用NaClO除去尿素CO(NH2)2时,生成物除盐外,都是能参与大气循环的物质,则该反应的化学方程式为_____________________;
(3)用MgCl26H2O制备无水MgCl2过程中,所需要的化学试剂是___________________;
(4)海水制溴过程中吸收潮湿空气中的Br2是利用SO2气体,SO2吸收Br2的离子方程式是_______________;SO2气体可来源于硫酸工业的尾气,同时,SO2尾气也可用氨水吸收,作为制备化肥的原料,SO2气体用氨水吸收得到的产物可能是___________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电化学气敏传感器可用于监制环境中 NH3 的含量,其工作原理示意图如图所示,下列说法不正确的是( )
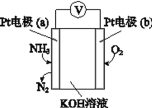
A.电池工作一段时间后pH将变大
B.反应消耗的NH3与O2的物质的量之比为4:3
C.负极的电极反应式为2NH36e6OHN26H2O
D.电流方向:电极b→导线→电极a→电解质溶液→电极b
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com