
【题目】按要求回答下列问题:
(1)已知拆开![]() 键、
键、![]() 键、
键、![]() 键分别需要吸收的能量为
键分别需要吸收的能量为![]() 、
、![]() 、
、![]() 。则由
。则由![]() 和
和![]() 反应生成1molHCl需要_______
反应生成1molHCl需要_______![]() 填“放出”或“吸收”
填“放出”或“吸收”![]() _________
_________![]() 的热量。
的热量。
(2)将等物质的量的A和B,混合于2 L的密闭容器中,发生如下反应 ![]() 。2min后,测得D的浓度为
。2min后,测得D的浓度为![]() mol/L ,
mol/L ,![]() ,C的反应速率是
,C的反应速率是![]() mol/(L·min)。则:
mol/(L·min)。则:
①x的值是__________;
②B的平均反应速率是____________;
③A在2min末的浓度是________________;
【答案】放出 92.25kJ 2 0.125 mol/(L·min) 0.75mol/L
【解析】
(1)反应方程式为:H2+Cl2=2HCl,根据吸收的能量之和与放出的能量判断反应的吸放热,并计算能量;
(2)利用三段式进行计算。
(1)反应方程式为:H2+Cl2=2HCl,生成2molHCl,则断键需吸收能量为:436.4kJ+242.7kJ=679.1kJ,形成新化学键放出能量为:2×431.8kJ=863.6kJ,放出的能量大于吸收的能量,则该反应放热,且放出:863.6kJ-679.1kJ=184.5kJ,因此生成1molHCl总的过程放热为:![]() ×184.5kJ=92.25kJ;
×184.5kJ=92.25kJ;
(2)①2min后,测得D的浓度为0.5mol/L,则v(D)=![]() =0.25mol/(L·min),C的反应速率是0.25mol/(L·min),根据化学速率之比等于化学计量数之比,x=2;
=0.25mol/(L·min),C的反应速率是0.25mol/(L·min),根据化学速率之比等于化学计量数之比,x=2;
②根据化学速率之比等于化学计量数之比,v(B)=![]() =
=![]() 0.25mol/(L·min)=0.125 mol/(L·min);
0.25mol/(L·min)=0.125 mol/(L·min);
③ 3A(g)+B(g) ![]() 2C(g)+2D(g)
2C(g)+2D(g)
起始浓度 a a 0 0
消耗浓度 0.75 0.25 0.5 0.5
平衡浓度 (a-0.75) (a-0.25) 0.5 0.5
根据c(A):c(B)=3:5,解得a=1.5mol/L,因此反应后c(A)=(1.5-0.75)mol/L=0.75mol/L。


 轻松课堂单元期中期末专题冲刺100分系列答案
轻松课堂单元期中期末专题冲刺100分系列答案科目:高中化学 来源: 题型:
【题目】某温度下在甲、乙、丙三个恒容密闭容器中,投入H2(g)和CO2(g),发生H2(g)+CO2(g)CO(g)+H2O(g),其起始浓度如表所示。已知:平衡时甲中CO气体的浓度为0.006mol/L。下列判断不正确的是( )
起始浓度(mol/L) | 甲 | 乙 | 丙 |
c(H2) | 0.010 | 0.020 | 0.020 |
c(CO2) | 0.010 | 0.010 | 0.020 |
A.反应开始时,丙中的反应速率最快,甲中的反应速率最慢
B.平衡时,甲、乙、丙中CO2的转化率有如下关系:乙>甲=丙=60%
C.平衡时,丙中c(CO2)是甲中的2倍,是0.012mol/L
D.改变条件使乙中温度降低,新平衡中H2的浓度增大,则正反应的△H>0
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一密闭容器中进行反应:X2(g)+Y2(g)![]() 2Z(g),若X2、Y2、Z的起始浓度分别为0.1mol/L、0.3mol/L、0.2mol/L,在一定条件下,当反应达到平衡状态时,下列说法正确的是
2Z(g),若X2、Y2、Z的起始浓度分别为0.1mol/L、0.3mol/L、0.2mol/L,在一定条件下,当反应达到平衡状态时,下列说法正确的是
A、Z的浓度可能为0.3mol/L
B、平衡时X2、Y2的转化率相等
C.平衡时,Y2和Z的生成速率之比为2:1
D、若平衡后再改变外界条件,升高温度,则反应的平衡常数将变大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度时,在一个2L的密闭容器中,X、Y、Z三种物质的物质的量随时间的变化曲线如图所示.根据图中数据填空:

(1)该反应的化学方程式为___________________________。
(2)反应开始至2min,以气体Z表示的平均反应速率为______________。
(3)平衡时X的转化率为_____________ 。
(4)若X、Y、Z均为气体,2min后反应达到平衡,反应达平衡时:①此时体系内压强与开始时压强之比为________________;②达平衡时,容器内混合气体的平均相对分子质量比起始投料时____________________(填“增大”“减小”或“相等”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,下列溶液的离子浓度关系式正确的是
A. pH=5的H2S溶液中,c(H+)= c(HS-)=1×10—5mol·L—1
B. pH=a的氨水溶液,稀释10倍后,其pH=b,则a=b+1
C. pH=2的H2C2O4溶液与pH=12的NaOH溶液任意比例混合:c(Na+)+ c(H+)= c(OH-)+c( HC2O4-)
D. pH相同的①CH3COO Na②NaHCO3③NaClO三种溶液的c(Na+):①>②>③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Fe、Cu、Mn三种元素的单质及化合物在生产、生活中有广泛应用.
![]()
![]() 是一种多功能材料,工业上常以
是一种多功能材料,工业上常以![]() 和尿素
和尿素![]() 、氧化剂等为原料制备.尿素分子中碳原子的杂化轨道类型为 ______ ,lmol尿素分子中含有的
、氧化剂等为原料制备.尿素分子中碳原子的杂化轨道类型为 ______ ,lmol尿素分子中含有的![]() 键数为 ______ .
键数为 ______ .
![]() 某学习小组拟以废旧于电池为原料制取锰,简易流程如下:
某学习小组拟以废旧于电池为原料制取锰,简易流程如下:
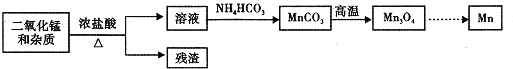
![]() 用浓盐酸溶解二氧化锰需保持通风,原因是 ______
用浓盐酸溶解二氧化锰需保持通风,原因是 ______ ![]() 用化学方程式表示
用化学方程式表示![]() .
.
![]() 写出碳酸锰在空气中灼烧生成四氧化三锰的化学方程式 ______ .
写出碳酸锰在空气中灼烧生成四氧化三锰的化学方程式 ______ .
![]() 基态铜原子的电子排布式为 ______ ,与Cu同周期且原子序数最小的第Ⅷ族元素,其基态原子核外有 ______ 个未成对电子.
基态铜原子的电子排布式为 ______ ,与Cu同周期且原子序数最小的第Ⅷ族元素,其基态原子核外有 ______ 个未成对电子.
![]() 图1是
图1是![]() 的晶胞结构,晶胞的边长为
的晶胞结构,晶胞的边长为![]() 则
则![]() 的密度为 ______
的密度为 ______ ![]() 用
用![]() 表示阿伏加德罗常数的值
表示阿伏加德罗常数的值![]() .
.
![]() 绿矾
绿矾![]() 是补血剂的原料,保存不当易变质.请设计实验检验绿矾是否完全变质 ______ .
是补血剂的原料,保存不当易变质.请设计实验检验绿矾是否完全变质 ______ .
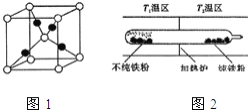
![]() 以羰基化合物为载体,提纯某纳米级活性铁粉
以羰基化合物为载体,提纯某纳米级活性铁粉![]() 含有一些不反应的杂质
含有一些不反应的杂质![]() ,反应装置如图
,反应装置如图![]() 已知:
已知:![]() ,常压下,
,常压下,![]()
![]() 的熔点约为
的熔点约为![]() ,沸点为
,沸点为![]() ,则
,则![]()
![]() 的晶体类型为 ______
的晶体类型为 ______ ![]() 请用平衡移动原理解释
请用平衡移动原理解释![]() 的原因 ______ .
的原因 ______ .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究小组探究在加热条件下FeSO4分解的气体产物及相关性质。已知:SO2的沸点为-10 ℃、SO3的沸点为44.8 ℃。
用如图所示装置设计实验,验证分解FeSO4生成的气态产物。
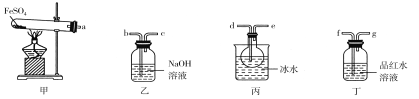
(1)实验前必须进行的操作是________。
(2)按气流方向连接各仪器,用字母表示接口的连接顺序:a→________。
(3)若观察到装置甲中固体变为红棕色,装置丙中有无色液体产生,装置丁中溶液变成无色,则FeSO4分解的化学方程式为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关电解质溶液的说法正确的是![]()
A.在蒸馏水中滴加浓![]() ,
,![]() 不变
不变
B.向![]() 溶液中滴加
溶液中滴加![]() 溶液,有沉淀和气体生成
溶液,有沉淀和气体生成
C.中和等体积等物质的量浓度的盐酸和醋酸,所消耗的氢氧化钠的物质的量相同
D.![]() 相等的
相等的![]() 溶液和
溶液和![]() 溶液,两溶液中水的电离程度相同
溶液,两溶液中水的电离程度相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列溶液中各微粒的浓度关系正确的是
A.等pH的醋酸溶液、盐酸溶液、硫酸溶液中:![]()
B.将10mL![]()
![]() 的
的![]() 溶液逐滴滴加到10mL
溶液逐滴滴加到10mL![]()
![]() 的盐酸中:
的盐酸中:![]()
C.向![]() 溶液中滴加NaOH溶液至
溶液中滴加NaOH溶液至![]() :
:![]()
D.![]()
![]() 的某一元弱酸HA溶液和
的某一元弱酸HA溶液和![]()
![]() 溶液等体积混合后的溶液:
溶液等体积混合后的溶液:![]()
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com