
【题目】现有A、B、C、D、E、F、G七种元素,其中A、B、C、D、E、F为短周期元素且原子序数依次增大;A的最高正价与最低负价的代数和为零;B的最高价氧化物与C的氢化物在水中反应得到的生成物X既可与酸反应又可与碱反应;标准状况下,D2气体的密度约是1.43 g/L;E原子半径在同周期中除稀有气体外最大,F原子M层上的电子比K层多5个。金属G的合金在生活中用量最大,用途最广。
(1)画出元素F形成的简单离子结构示意图_______;
(2)若X为正盐,则其中所含的化学键类型有_______________;若X为酸式盐,则它与足量E的最高价氧化物对应水化物的稀溶液反应的离子方程式为_________________;
(3)以下三种说法中,可以验证B和F原子得电子能力强弱的是______________(填写编号)
a.比较这两种元素的常见单质的沸点
b.二者形成的化合物中,F元素的原子显负价
c.比较这两种元素的气态氢化物的稳定性
(4)向A和F形成的化合物的水溶液中加入少量G单质,反应后,再向溶液申加入A与D形成的化合物,发现溶液颜色变黄,请用离子方程式解释溶液变黄的原因____________。
(5)元素A和C的常见单质都是重要的化工原料,可发生反应:C2(g)+ 3A2 (g)![]() 2CA3 (g),且己知反应物总能量高于生成物总能量。
2CA3 (g),且己知反应物总能量高于生成物总能量。
①用电子式表示C2的形成过程________________。
②己知常温下拆开1 molA-A键、1 molA-C键、1mol![]() 键分别需要吸收的能量为a kJ、b kJ、c kJ,则按上述反应生成1molCA3的过程中的能量变化为:_________(填“吸收”或“放出”) ______kJ。
键分别需要吸收的能量为a kJ、b kJ、c kJ,则按上述反应生成1molCA3的过程中的能量变化为:_________(填“吸收”或“放出”) ______kJ。
【答案】 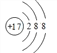 离子键、极性键(答共价键亦可) NH4++ HCO3-+2OH-= CO32-+ H2O+NH3·H2O bc 2Fe2++ H2O2+2H+= 2Fe3++ 2H2O
离子键、极性键(答共价键亦可) NH4++ HCO3-+2OH-= CO32-+ H2O+NH3·H2O bc 2Fe2++ H2O2+2H+= 2Fe3++ 2H2O ![]() 放出 (6b-3a-c)/2
放出 (6b-3a-c)/2
【解析】本题考查元素的推断,D2气体的密度约为1.43g·L-1,即D2的摩尔质量为22.4×1.43g·mol-1=32g·mol-1,即D为O,E原子半径在同周期中除稀有气体外最大,几种元素的原子序数依次增大,即E为Na, F原子M层上的电子比K层多5个,即F为Cl,金属G的合金在生活中用量最大,用途最广,因此G为Fe,A的最高正价与最低负价的代数和为0,又因为原子序数增大,因此推出A为H,B的最高价氧化物与C的氢化物在水中反应得到X,推测出X为铵盐,X既可以与酸反应又能与碱反应,因此推出B为C,C为N,(1)Cl的离子形式为Cl-,即结构示意图为 ;(2)若X为正盐,则为(NH4)2CO3,所含化学键为离子键、(极性)共价键;X为酸式盐,则为NH4HCO3,E的最高价氧化物的水化物是NaOH,反应离子反应式为NH4++HCO3-+2OH-=CO32-+H2O+NH3·H2O; (3) a、沸点是物理性质,与得电子能力强弱无关,故a错误;b、形成的化合物是CCl4,Cl显负价,说明电子对偏向Cl,即Cl的的电子能力强于C,故b正确;c、非金属性越强,其氢化物越稳定,因此比较B和F的非金属性强弱,故c错误;(4)A和F形成的化合物为HCl,加入铁单质,发生Fe+2HCl=FeCl2+H2↑,Fe2+显浅绿色,加入A与D形成的化合物,溶液的颜色变为黄色,即Fe2+→Fe3+,说明A与D形成的化合物具有氧化性,即为H2O2,离子反应方程式为2Fe2++H2O2+2H+=2Fe3++2H2O;(5)①C2为N2,电子式表示形成的过程:
;(2)若X为正盐,则为(NH4)2CO3,所含化学键为离子键、(极性)共价键;X为酸式盐,则为NH4HCO3,E的最高价氧化物的水化物是NaOH,反应离子反应式为NH4++HCO3-+2OH-=CO32-+H2O+NH3·H2O; (3) a、沸点是物理性质,与得电子能力强弱无关,故a错误;b、形成的化合物是CCl4,Cl显负价,说明电子对偏向Cl,即Cl的的电子能力强于C,故b正确;c、非金属性越强,其氢化物越稳定,因此比较B和F的非金属性强弱,故c错误;(4)A和F形成的化合物为HCl,加入铁单质,发生Fe+2HCl=FeCl2+H2↑,Fe2+显浅绿色,加入A与D形成的化合物,溶液的颜色变为黄色,即Fe2+→Fe3+,说明A与D形成的化合物具有氧化性,即为H2O2,离子反应方程式为2Fe2++H2O2+2H+=2Fe3++2H2O;(5)①C2为N2,电子式表示形成的过程:![]() ;②根据信息,反应物的总能量大于生成物的总能量,说明此反应是放出能量,反应物中断键吸收能量为:(3a+c)kJ·mol-1,形成化学键放出的能量为6bkJ·mol-1,此反应是放出能量,因此生成2molNH3是放出能量为(6b-3a-c)kJ·mol-1,则生成1molNH3是放出能量为(6b-3a-c)/2kJ·mol-1。
;②根据信息,反应物的总能量大于生成物的总能量,说明此反应是放出能量,反应物中断键吸收能量为:(3a+c)kJ·mol-1,形成化学键放出的能量为6bkJ·mol-1,此反应是放出能量,因此生成2molNH3是放出能量为(6b-3a-c)kJ·mol-1,则生成1molNH3是放出能量为(6b-3a-c)/2kJ·mol-1。


科目:高中化学 来源: 题型:
【题目】下列图示与对应的叙述正确的是

A.图甲为在水溶液中H+和OH-的浓度变化曲线,恒温稀释可实现a→b的转化
B.图乙为H2O2在有、无催化剂下的分解反应曲线b表示有催化剂时的反应
C.图丙可表示用0.0110mol/L盐酸滴定0.0110mol/L氨水时的滴定曲线
D.图丁为NaCl中混有少量KNO3,除去KNO3可在较高温度下制得浓溶液再冷却结晶、过滤、干燥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于煤、石油、天然气等资源的说法正确的是 ( )
A. 石油裂解得到的汽油是纯净物 B. 石油产品都可用于聚合反应
C. 天然气是一种清洁的化石燃料 D. 水煤气是通过煤的液化得到的气体燃料
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】—定温度下,将一定量的冰醋酸加水稀释,稀释过程中溶液的导电性变化如图所示

则下列说法错误的是
A. 醋酸的电离程度:a<b<c
B. 溶液的pH值:b<a<c
C. 蘸取a点溶液滴在湿润的pH试纸上,测得pH值一定偏大
D. 若分别取a、b、c三点的溶液各10 mL,各用同浓度的氢氧化钠溶液中和,消耗NaOH溶液的体积a=b=c
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(2014福建)元素周期表中第VIIA族元素的单质及其化合物的用途广泛。
(1)与氯元素同族的短周期元素的原子结构示意图为 。
(2)能作为氯、溴、碘元素非金属性(原子得电子能力)递变规律的判断依据是 (填序号)。
a.Cl2、Br2、I2的熔点 b. Cl2、Br2、I2的氧化性
c.HCl、HBr、HI的热稳定性 d. HCl、HBr、HI的酸性
(3)工业上,通过如下转化可制得KClO3晶体:
NaCl溶液![]() NaClO3溶液
NaClO3溶液![]() KClO3晶体
KClO3晶体
① 完成I中反应的总化学方程式:□NaCl+□H2O=□NaClO3+□ 。
② II中转化的基本反应类型是 ,该反应过程能析出KClO3晶体而无其它晶体析出的原因是 。
(4)一定条件,在水溶液中1 mol Cl-、ClO-(x=1,2,3,4)的能量(KJ)相对大小如右图所示。
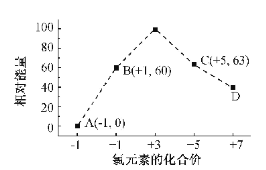
① D是 (填离子符号)。
② B→A+C反应的热化学方程式为 (用离子符号表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验能获得成功的是( )
A. 乙醇中含乙酸杂质,可加入碳酸钠溶液洗涤、分液除去
B. 苯、溴水、铁粉混合制成溴苯
C. 用高锰酸钾酸性溶液来区别甲烷和乙烯
D. 可用分液漏斗分离乙醇和水
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列操作或试剂的选择不合理的是( )
A. 可用蒸发结晶的方法从碘水中提取碘单质
B. 可用灼烧法除去氧化铜中混有的铜粉
C. 可用硫酸鉴别碳酸钠、硅酸钠和硫酸钠
D. 可用含氢氧化钠的氢氧化铜悬浊液鉴别乙醇、乙醛和乙酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】成熟的苹果中含有淀粉、葡萄糖和无机盐等,某课外兴趣小组设计了一组实验证明某些成分的存在,请你参与并协助他们完成相关实验。
(1)取少量苹果汁,加入碘水,溶液变蓝,则苹果中含有____________。
(2)取少量苹果汁,加入新制Cu(OH)2并加热,产生红色沉淀,则苹果中含有__________。
(3)葡萄糖在一定条件下可以得到乙醇。写出乙醇与乙酸反应的化学方程式:______________。
下列物质中可以鉴别乙酸和乙醇的是__________(填字母)。
A.金属钠 B.碳酸钠溶液
C.水 D.紫色石蕊试液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将1mol纯净的氨基甲酸铵(NH2COONH4)置于特制的真空密闭容器中(假设容器体积不变,固体试样体积忽略不计),在恒定温度下使其分解达到平衡:NH2COONH4 ![]() 2NH3(g)+CO2(g)(s-固态,g-气态)下列可以判断该反应己经达到化学平衡状态的是
2NH3(g)+CO2(g)(s-固态,g-气态)下列可以判断该反应己经达到化学平衡状态的是
A. 反应速率:v(正)=v(逆)=0 B. 有2molNH3生成
C. 气体的总体积保持不变 D. CO2的质量保持不变
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com