
【题目】在一定温度下的定容容器中,当下列物理量不再发生变化时:①混合气体的压强,②混合气体的密度,③混合气体的总质量,④混合气体的平均相对分子质量,⑤混合气体的颜色,⑥各反应物或生成物的浓度之比等于化学计量数之比,⑦某种气体的百分含量,上述能说明2NO2(g) ![]() N2O4(g)达到平衡状态的有( )个
N2O4(g)达到平衡状态的有( )个
A.4B.6C.3D.5
【答案】A
【解析】
①因为反应前后气体的分子数不等,所以当混合气体的压强不变时,反应达平衡状态,①符合题意;
②因为气体的总质量不变,容器的体积不变,所以混合气体的密度始终不变,密度不变时,反应不一定达平衡状态,②不合题意;
③反应物和生成物都呈气态,混合气的总质量始终不变,所以当混合气的总质量不变时,反应不一定达平衡状态,③不合题意;
④因为混合气的总质量不变,反应前后气体分子数不等,所以当混合气体的平均相对分子质量不变时,反应达平衡状态,④符合题意;
⑤混合气体的颜色取决于c(NO2),c(NO2)不变时,反应达平衡状态,⑤符合题意;
⑥只有反应物的投入量之比等于化学计量数之比,且反应物的转化率为50%时,各反应物或生成物的浓度之比才等于化学计量数之比,但此时不一定是平衡状态,⑥不合题意;
⑦只有当反应达平衡状态时,某种气体的百分含量才保持不变,⑦符合题意。
综合以上分析,共有4项符合题意。故选A。


科目:高中化学 来源: 题型:
【题目】元素W、X、Y、Z的原子序数依次增加,p、q、r是由这些元素组成的二元化合物;m、n分别是元素Y、Z的单质,n通常为深红棕色液体,p为最简单的芳香烃,s通常是难溶于水、密度比水大的油状液体。上述物质的转化关系如图所示:
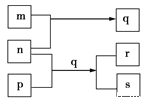
(1)q的溶液显______性(填“酸”“碱”或“中”),理由是:_________(用离子方程式说明)。
(2)s的化学式为______,Z在周期表中的位置为_____________。
(3)X、Y两种元素组成的化合物能溶于足量的浓硝酸,产生无色气体与红棕色气体的体积比为1:13,则该化合物的化学式为____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】无色的混合气体甲中可能含有NO、CO2、NO2、NH3、N2中的几种,将100mL气体甲经过如图所示实验处理,结果得到酸性溶液,而几乎无气体剩余,则气体甲的组成可能为( )
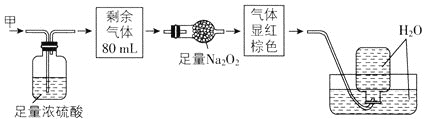
A.NO2、NH3、N2B.NH3、NO、CO2
C.NH3、NO2、CO2D.NO、CO2、N2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)臭氧可用于烟气脱硝。O3氧化NO结合水洗,可产生HNO3和O2,该反应的化学方程式为_________________________。
(2)如图是用NH3脱除烟气中NO的原理。
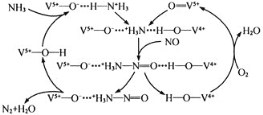
①该脱硝原理中,NO最终转化为__________(填化学式)和H2O。
②当消耗2mLNH3和0.5molO2时,除去的NO在标准状况下的体积为________L。
(3)用碱液脱硝是目前研究的课题之一。
①将NO、NO2通入石灰乳中可制备重要的工业原料Ca(NO3)2。该工艺需控制NO和NO2物质的量之比接近1:1。若n(NO2):n(NO)>1:1,则会导致_____________;若n(NO2):n(NO)<1:1,则会导致_____________。
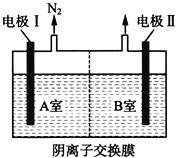
②将氢氧化钠溶液脱硝得到的NaNO2、NaNO3的混合液和NaOH溶液分别加到如图所示的电解槽中进行电解。写出A室NO2-发生的电极反应式:______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用NA表示阿伏加德罗常数的值,下列叙述中正确的是( )
A.1L含NA个Al3+的Al(NO3)3溶液中,NO3-物质的量浓度等于3mol/L
B.31g白磷中含有1.5NA个P-P
C.标准状况下,22.4L HF含NA个分子
D.标准状况下,1 molCl2溶于水,转移的电子数目为NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组中的反应,属于同一反应类型的是
A. 由溴丙烷水解制丙醇;由丙烯与水反应制丙醇
B. 由甲苯硝化制对硝基甲苯;由甲苯氧化制苯甲酸
C. 由氯代环己烷消去制环己烯;由丙烯加溴制![]() 二溴丙烷
二溴丙烷
D. 由乙酸和乙醇制乙酸乙酯;由苯甲酸乙酯水解制苯甲酸和乙醇
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以铝土矿(主要成分为![]() )为原料冶炼金属铝,主要步骤包括:①将粉碎后的铝土矿溶解在氢氧化钠溶液中;②向①的所得溶液中通入过量二氧化碳,获得氢氧化铝固体;③使氢氧化铝脱水生成氧化铝;④……
)为原料冶炼金属铝,主要步骤包括:①将粉碎后的铝土矿溶解在氢氧化钠溶液中;②向①的所得溶液中通入过量二氧化碳,获得氢氧化铝固体;③使氢氧化铝脱水生成氧化铝;④……
(1)步骤④为冶炼金属铝的过程,应选择的方法是______(填序号)。
A.以C、![]() 或
或![]() 作还原剂 B.热分解法 C.利用铝热反应原理还原 D.电解法
作还原剂 B.热分解法 C.利用铝热反应原理还原 D.电解法
(2)步骤③所涉及反应的化学方程式为_____________________________________________。
(3)步骤①所涉及反应的离子方程式为_________________________________________________。
(4)步骤②至步骤③的过程中,须经过_____操作。
(5)步骤②所得溶液中含有的大量阴离子是________________(填离子符号)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将石油分馏得到的重油进行裂化可以获得较多的轻质燃油。某研究性学习小组模拟工业.上石油的催化裂化设计了如图所示实验装置。实验过程中可观察到烧瓶中固体石蜡先熔化,试管II中有少量液体生成,试管巩中酸性高锰酸钾溶液褪色,实验后闻试管II中液体的气味,发现其具有汽油的气味。

资料一 石蜡是含有20 ~ 30个碳原子的烷烃组成的混合物,常温下呈固态。
资料二 石油催化裂化过程中通常使用![]() 作催化剂。
作催化剂。
(1)为保证实验成功,实验前必须进行的操作是_________________;装置中长导管的作用是________________________。
(2)试管II中有少量液体生成说明________________。
(3)试管III中溶液褪色说明_______________________。
(4)_______(填“能”或“不能”)用试管II中的液体萃取溴水中的溴,理由是___________。
(5)写出二十烷裂化得到癸烷和癸烯的化学方程式:___________________________。
(6)石油裂化的主要目的是_______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二氯化二硫(S2Cl2)是一种重要的化工原料,常用作橡胶硫化剂,改变生橡胶受热发粘、遇冷变硬的性质。查阅资料可知S2Cl2具有下列性质:
物理性质 | 毒性 | 色态 | 挥发性 | 熔点 | 沸点 |
剧毒 | 金黄色液体 | 易挥发 | -76℃ | 138℃ | |
化学性质 | ①300℃以上完全分解;②S2Cl2+Cl2 ③遇高热或与明火接触,有引起燃烧的危险 ④受热或遇水分解放热,放出腐蚀性烟气 | ||||
实验室可利用硫与少量氯气在110~140℃反应制得S2Cl2粗品。下面是制取少量S2Cl2的装置,回答下列问题:
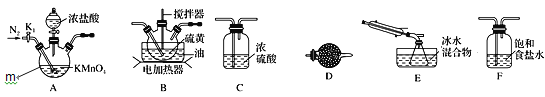
(1)仪器m的名称为______。
(2)S2Cl2的电子式为______。
(3)装置连接顺序:______→E→D。
(4)为了提高S2Cl2的纯度,实验的关键是控制好温度和________。
(5)S2Cl2遇水强烈反应产生烟雾,其产物中有一种气体X能使品红溶液褪色,加热后又恢复原状 且反应过程中只有一种元素化合价发生变化,写出该反应的化学方程式_______。
(6)某同学为了测定S2Cl2与水反应后生成的气体X在混合气体中的体积分数设计了如下实验方案:
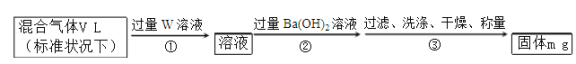
该混合气体中气体X的体积分数为_____(用含V、m的式子表示)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com