
【题目】如表所示有关物质检验的实验结论正确的是( )
选项 | 实验操作及现象 | 实验结论 |
A | 向某溶液中加入盐酸酸化的氯化钡溶液,有白色沉淀产生 | 该溶液中一定含有SO42- |
B | 向某溶液中加入盐酸,将生成的气体通入品红溶液中,品红溶液褪色 | 该溶液一定含有 SO32- |
C | 将某气体通入品红溶液中,品红溶液褪色 | 说明酸性:H2SO3>H2CO3 |
D | 某气体先通入足量的酸性 KMnO4 溶液,再通入澄清石灰水中有浑浊 | 该气体一定是 CO2 |
A.AB.BC.CD.D
 第1卷单元月考期中期末系列答案
第1卷单元月考期中期末系列答案科目:高中化学 来源: 题型:
【题目】为探究乙烯与溴的加成反应,甲同学设计并进行如下实验:先取一定量的工业用乙烯气体(在储气瓶中),使气体通入溴水中,发现溶液褪色,即证明乙烯与溴水发生了加成反应;乙同学发现在甲同学的实验中,褪色后的溶液里有少许淡黄色浑浊物质,推测在工业上制得的乙烯中还可能含有少量还原性气体杂质,由此他提出必须先除去杂质,再让乙烯与溴水反应。请回答下列问题:
(1)甲同学设计的实验________(填“能”或“不能”)验证乙烯与溴发生了加成反应,其理由是________(填序号)。
①使溴水褪色的反应不一定是加成反应
②使溴水褪色的反应就是加成反应
③使溴水褪色的物质不一定是乙烯
④使溴水褪色的物质就是乙烯
(2)乙同学推测此乙烯中一定含有的一种杂质气体是________,它与溴水反应的化学方程式是________________。在实验前必须全部除去,除去该杂质的试剂可用________。
(3)为验证乙烯与溴发生的反应是加成反应而不是取代反应,丙同学提出可用![]() 试纸来测试反应后溶液的酸性,理由是_____________________________________________________________________________。
试纸来测试反应后溶液的酸性,理由是_____________________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与生活、人类生产、社会可持续发展密切相关,下列说法正确的是( )
A.合成材料、光伏材料和复合材料都是新型无机非金属材料
B.晋代![]() 抱扑子
抱扑子![]() 中记载有“丹砂烧之成水银,积变又还成丹砂”是指加热时丹砂
中记载有“丹砂烧之成水银,积变又还成丹砂”是指加热时丹砂![]() 熔融成液态,遇冷又重新凝结成HgS晶体
熔融成液态,遇冷又重新凝结成HgS晶体
C.煤的干馏是化学变化,煤的气化、液化和石油的分馏都是物理变化
D.![]() 本草经集注
本草经集注![]() 中记载了区别硝石
中记载了区别硝石![]() 和朴硝
和朴硝![]() 的方法:“以火烧之,紫青烟起,乃真硝石也”这是运用了“焰色反应”的原理
的方法:“以火烧之,紫青烟起,乃真硝石也”这是运用了“焰色反应”的原理
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】卤族元素的单质和化合物很多,利用所学物质结构与性质的知识去认识和理解它们。
(1)溴的核外电子排布式为__。
(2)在不太稀的溶液中,氢氟酸是以二分子缔合(HF)2形式存在。使氢氟酸分子缔合作用力是___。
(3)下列曲线表示卤族元素某种性质随核电荷数递增的变化趋势,正确的是___。

(4)已知高碘酸有两种形式,化学式分别为H5IO6(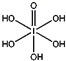 )和HIO4,前者为五元酸,后者为一元酸。请比较二者酸性强弱:H5IO6___HIO4(填“>”、“<”或“=”)。IO
)和HIO4,前者为五元酸,后者为一元酸。请比较二者酸性强弱:H5IO6___HIO4(填“>”、“<”或“=”)。IO![]() 的VSEPR模型为__。
的VSEPR模型为__。
(5)铜与氯形成化合物的晶胞如附图所示(黑点代表铜粒子)。

①该晶体的化学式为__。
②一定条件下,Cu2O比CuO更稳定的原因是__。
③已知该晶体的密度为ρg·cm-3,阿伏加德罗常数为NA,则该晶体的边长为__pm。(用含ρ、NA的式子表示)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究化学反应与能量的变化具有重要意义。
![]() 已知
已知![]() 的反应过程的能量变化如图1:
的反应过程的能量变化如图1:

![]() 该反应通常用
该反应通常用![]() 作为催化剂,加入
作为催化剂,加入![]() 会使图中的B点________
会使图中的B点________![]() 填“升高”、“不变”或“降低”
填“升高”、“不变”或“降低”![]() 。
。
![]() E
E![]() 表示的意义为___________。
表示的意义为___________。
![]() 如图2中的a和b为氢镍可充电碱性电池的电极,该电池总反应式为:
如图2中的a和b为氢镍可充电碱性电池的电极,该电池总反应式为:![]()
![]() 为了实现铜与稀硫酸反应,用Z通入氧气的同时,将开关K与Y相连即可。石墨电极的反应式为___________,总反应的化学方程式为__________。
为了实现铜与稀硫酸反应,用Z通入氧气的同时,将开关K与Y相连即可。石墨电极的反应式为___________,总反应的化学方程式为__________。
![]() 不通入氧气,直接将K与X相连也能实现铜与稀硫酸反应。则氢镍碱性电池的负极为____
不通入氧气,直接将K与X相连也能实现铜与稀硫酸反应。则氢镍碱性电池的负极为____![]() 填“a”或“b”
填“a”或“b”![]() ,电解槽内总反应的离子方程式为______________________。
,电解槽内总反应的离子方程式为______________________。
![]() 当给氢镍碱性电池充电时,该电池的正极反应式为______;氢镍电池放电时,负极附近的pH会________
当给氢镍碱性电池充电时,该电池的正极反应式为______;氢镍电池放电时,负极附近的pH会________![]() 填“变大”、“不变”或“变小”
填“变大”、“不变”或“变小”![]() 。
。
![]() 若将
若将![]() 题图2中的稀硫酸换成
题图2中的稀硫酸换成![]() 溶液,并且将氢镍碱性电池的电极反接,将K连接X,通电一段时间后,向所得溶液中加入
溶液,并且将氢镍碱性电池的电极反接,将K连接X,通电一段时间后,向所得溶液中加入![]() 碱式碳酸铜
碱式碳酸铜![]() 后,恰好恢复到原来的浓度和
后,恰好恢复到原来的浓度和![]() 不考虑
不考虑![]() 的溶解
的溶解![]() ,则电解过程中转移电子的物质的量为__________。
,则电解过程中转移电子的物质的量为__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列方程式书写正确的是
A.NaHSO4在熔融状态下的电离方程式:NaHSO4=Na++HSO4-
B.H2SO4溶液与NaOH溶液发生中和反应的热化学方程式为(已知H2SO4 溶液与NaOH溶液发生反应的中和热为57.3 kJ/mol):H2SO4(aq)+2NaOH(aq)=2H2O(l)+Na2SO4(aq) △H=-57.3kJ/mol
C.CO32-的水解方程式:CO32-+2H2O![]() H2CO3+2OH-
H2CO3+2OH-
D.CaCO3的沉淀溶解平衡方程式:CaCO3(s)=Ca2+(aq)+CO32-(aq)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于反应C(s)+H2O(g)![]() CO(g)+H2(g),ΔH=+206.4 kJ·mol-1,一定可以提高平衡体系中H2百分含量,又能加快反应速率的措施是
CO(g)+H2(g),ΔH=+206.4 kJ·mol-1,一定可以提高平衡体系中H2百分含量,又能加快反应速率的措施是
A.升高温度B.增大水蒸气浓度
C.加入大量CD.降低压强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种三室微生物燃料电池污水净化系统原理如图所示,图中有机废水中有机物可用C6H10O5 表示。有关说法正确的是

A. 该装置为原电池,b为原电池的负极
B. 中间室Na+移向右室,Cl-移向左室,a极区溶液的pH减小
C. 当左室有4.48L(标准状况下)CO2生成时,右室产生的N2为0.8mol
D. b电极反应式:C6H10O5-24e-+7H2O===6CO2↑+24H+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以高硫铝土矿![]() 主要成分为
主要成分为![]() 、
、![]() 、
、![]() ,少量
,少量![]() 和金属硫酸盐
和金属硫酸盐![]() 为原料,生产氧化铝并获得
为原料,生产氧化铝并获得![]() 的部分工艺流程如下:
的部分工艺流程如下:

![]() 粉碎高硫铝土矿石的目的是______。
粉碎高硫铝土矿石的目的是______。
![]() 焙烧时发生氧化还原反应:______
焙烧时发生氧化还原反应:______![]() ______
______![]() ______
______![]() ______
______![]() ,配平该方程式。
,配平该方程式。
![]() 碱浸时发生反应的化学方程式为______。
碱浸时发生反应的化学方程式为______。
![]() 过滤后向滤液中通入过量的
过滤后向滤液中通入过量的![]() 气体,反应的离子方程式为______。
气体,反应的离子方程式为______。
![]() “过滤”得到的滤渣中含有大量的
“过滤”得到的滤渣中含有大量的![]() 与
与![]() 混合后在缺氧条件下焙烧生成
混合后在缺氧条件下焙烧生成![]() 和
和![]() ,理论上完全反应消耗的
,理论上完全反应消耗的![]() :
:![]() ______。
______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com