
����Ŀ�����нΣ����ʵ�����ʧ���ķ�Ӧ��������ԭ��Ӧ�����нΣ�������Ԫ�ػ��ϼ������Ļ�ѧ��Ӧ����������ԭ��Ӧ��Ԫ�ػ��ϼ����ߵ�Ϊ��ԭ��������������Ӧ��Ԫ�ػ��ϼ۽��͵�Ϊ��������������ԭ��Ӧ��������Ӧ�ͻ�ԭ��Ӧͬʱ�����ģ������ķ�Ӧ��Ϊ������ԭ��Ӧ����ش��������⣺
��1�����ݻ��ϼ۸ı��ж��������ֻ�����Ӧ���ͣ�һ������������ԭ��Ӧ����____��(ѡ����ĸ��ţ�
A�����Ϸ�ӦB���ֽⷴӦC���û���Ӧ D�����ֽⷴӦ
��2���ڻ�ѧ��ӦFe+CuSO4=Cu+FeSO4�У��÷�Ӧ�Ļ�ԭ����_____(�ѧʽ)��
��3�����з�Ӧ�У�������Ӧ�뻹ԭ��Ӧ��ͬһԪ���н��е���________��(��ѡ��ѡ����ĸ��ţ�
A��C12+2NaOH=NaCl+NaClO+H2OB��4P+5O2![]() 2P2O5
2P2O5
C��Zn+CuCl2=Cu+ZnCl2 D��3NO2+H2O=2HNO3+NO
���𰸡�DFeAD
��������
(1) A�����Ϸ�Ӧ�п�����Ԫ�ػ��ϼ۵ı仯�����Կ�����������ԭ��Ӧ��B���ֽⷴӦ�п�����Ԫ�ػ��ϼ۵ı仯�����Կ�����������ԭ��Ӧ�� C���û���Ӧ��һ����Ԫ�ػ��ϼ۵ı仯��һ����������ԭ��Ӧ��D�����ֽⷴӦ�����ֽ����ɷ֣��϶������ڻ��ϼ۵ı仯��һ������������ԭ��Ӧ����ѡD�� (2)�ڷ�Ӧ����Ԫ�ػ��ϼ����ߣ�����ԭ����(3) A.��Ӧ��ֻ����Ԫ�ػ��ϼ۱仯������ȷ��B.��Ӧ����Ԫ�ػ��ϼ����ߣ���Ԫ�ػ��ϼ۽��ͣ��ʴ���C.��Ӧ��п��ͭԪ�ػ��ϼ۱仯���ʴ���D.��Ӧ�е�Ԫ�ػ��ϼ�������������ȷ����ѡAD��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����һ��Ũ����ɫ��Һ�������м���������BaCl2��Һ��ϡHNO3 �� ���а�ɫ�������ɣ���ԭ��Һ�д��ڵ����ӣ� ��
A.ֻ��SO42��
B.ֻ��Ag+
C.��SO42����Ag+
D.��SO42����Ag+
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��(1)5 mol��CO2��8 mol��SO2�ķ�����֮����________��ԭ����֮����________����������________��
(2)KClO3��ŨHCl��һ���¶��·�Ӧ�����ɻ���ɫ���ױ���������ȡ��䷴Ӧ�ɱ���Ϊ��________KClO3��________HCl(Ũ)===________KCl��________ClO2����________Cl2����________H2O
����ƽ���ϻ�ѧ����ʽ(��ѧ���������뻮����)��
��ClO2�Ƿ�Ӧ��________(���������ԭ��)���Ũ�����ڷ�Ӧ����ʾ������������(��д����)________��
a����ԭ�� b�������� c������ d������
�۷�Ӧ����0.1 mol Cl2����ת�Ƶĵ��ӵ����ʵ���Ϊ________ mol��
��ClO2���к�ǿ�������ԣ���˿ɱ�����������������ClO2����������������ת��ΪCl��������������Ч��(�Ե�λ�����õ���������ʾ)��Cl2��________��(����2λС��)��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����������������ճ�����������Ӧ�ù㷺�IJ��ϣ���ش��������⣺
��1����̬��ԭ�ӵļ۵����Ų�ʽΪ_________��
��2��Fe3+��Co3+��N3+��CN-�ȿ��γ�������ӡ�
��C��N��O�е�һ����������Ϊ________����ԭ����_____________________��
��K3[Fe(CN)6]�����ڼ���Fe2+��1mol K3[Fe(CN)6]�к��ЦҼ�����ĿΪ________________��
��3��������һ�������Fe(CO)x������ԭ�Ӽ۵������������ṩ�ĵ�����֮��Ϊ18����x=_____����
֪���������۵�Ϊ-20.5 �棬�е�Ϊ103�棬������CCl4���ݴ˿����ж�Fe(CO)x��������_____________��������ͣ���
��4��������������ԭ�Ӳ���_________�ѻ���������Ŀռ�������Ϊ______���ú��е�ʽ�ӱ�ʾ����
��5��ij�����������������ᄃ����ͼ��ʾ������A��B ������ɡ���û�������Fe2+��Fe3+��O2-�ĸ�����Ϊ_______________������������ȣ�����֪�þ�����ܶ�Ϊd g��cm-3�������ӵ�������ֵΪNA��������aΪ_______________nm���ú�d��NA�Ĵ���ʽ��ʾ����
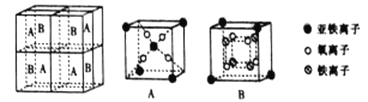
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����еݱ���ɲ���ȷ����
A.Na��Mg��Alԭ�ӵ�ʧ������������
B.Si��P��SԪ�ص���������ϼ����ν���
C.C��N��O��ԭ�Ӱ뾶���μ�С
D.Cl��Br��I����̬�⻯����ȶ������μ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������£���1.000mol/L �������20.00mL1.000 mol/L ��ˮ�У���ҺpH���¶��������������仯������ͼ��ʾ��
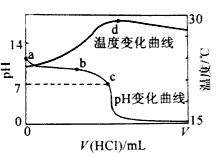
�����й�˵������ȷ���ǣ� ��
A. a ����ˮ�������c(H+)>1.0��10-14mol/L
B. b �㣺 c(NH4+)>c(Cl-)
C. c �㣺 c(Cl-)=c(NH4+)
D. d �����Һ�¶����½�����Ҫԭ����NH3��H2O ��������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����1�������г�����һЩԭ�ӵ�2p�ܼ���3d�ܼ��е����Ų�����������ж�,Υ��������ԭ������___,Υ���˺��ع������___��
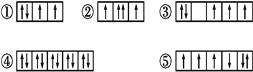
��2��ijԪ�صļ���̬(���ȶ�״̬)ԭ�ӵĵ����Ų�ʽΪ1s22s22p63s13p33d2,���Ԫ�ػ�̬ԭ�ӵĵ����Ų�ʽΪ___;������������Ӧˮ����Ļ�ѧʽ��___��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪������Ԫ��X�������������ǵ��Ӳ�����2������XԪ�����������������ǣ� ��
A.0B.��AC.��AD.��A
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������й���ϩ��˵���������( )
A. ������ɺ������ҵ�ʯ�ͻ�����չˮƽB. ����ʹ���Ը��������Һ��ɫ
C. �ڹ�ҵ��������������ϩ����D. ��ũҵ����ֲ���������ڼ�
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com