
【题目】通常人们把拆开1 mol某化学键所吸收的能量看成该化学键的键能,键能的大小可用于估算化学反应的反应热(ΔH),已知如下化学键的键能:
化学键 | H—H | Cl—Cl | H—Cl |
生成1 mol化学键时放出的能量 | 436kJ/mol | 243kJ/mol | 431kJ/mol |
则下列热化学方程式不正确的是
A.![]() H2(g)+
H2(g)+![]() Cl2(g)=HCl(g) ΔH=-91.5kJ/mol
Cl2(g)=HCl(g) ΔH=-91.5kJ/mol
B.H2(g)+Cl2(g)=2HCl(g) ΔH=-183kJ/mol
C.2HCl(g)=H2(g)+Cl2(g) ΔH=+183kJ/mol
D.![]() H2(g)+
H2(g)+![]() Cl2(g)=HCl(g) ΔH=+91.5kJ/mol
Cl2(g)=HCl(g) ΔH=+91.5kJ/mol
【答案】D
【解析】
反应热ΔH=反应物总键能-生成物总键能,反应H2(g)+Cl2(g)=2HCl(g)的 ΔH=436kJ/mol +243 kJ/mol-431 kJ/mol×2=-183 kJ/mol。
A.热化学方程式的焓变与方程式中计量数成正比,则![]() H2(g)+
H2(g)+![]() Cl2(g)=HCl(g) ΔH=-91.5kJ/mol ,A正确;
Cl2(g)=HCl(g) ΔH=-91.5kJ/mol ,A正确;
B.反应热ΔH=反应物总键能-生成物总键能,反应H2(g)+Cl2(g)=2HCl(g)的 ΔH=436kJ/mol +243 kJ/mol-431 kJ/mol×2=-183 kJ/mol,B正确,
C. 反应H2(g)+Cl2(g)=2HCl(g)的 ΔH=436kJ/mol +243 kJ/mol-431 kJ/mol×2=-183 kJ/mol,则2HCl(g)=H2(g)+Cl2(g)的反应热ΔH=+183kJ/mol,C正确;
D.由于该反应为放热反应,焓变小于零,D错误;
答案选D。


科目:高中化学 来源: 题型:
【题目】科学家利用太阳能分解水生成的氢气在催化剂作用下与CO2反应生成甲醇。已知:H2(g)、CO(g)和CH3OH(l)的燃烧热ΔH分别为285.8kJ·mol1、283.0kJ·mol1和726.5kJ·mol1。
请回答下列问题:
(1)用太阳能分解10mol水消耗的能量是______kJ。
(2)写出表示H2(g)、CO(g)和CH3OH(l)燃烧热的热化学方程式。
①H2:__________;
②CO:__________;
③CH3OH:_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是某条件下N2与H2反应过程中能量变化的曲线图.根据图象判断下列叙述中正确的是( )
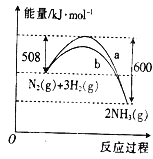
A. 该反应的热化学方程式为N2(g)+3H2(g)![]() 2NH3(g) △H=+92kJ·mol﹣1
2NH3(g) △H=+92kJ·mol﹣1
B. a曲线是加入催化剂时的能量变化曲线
C. 加入催化剂,该化学反应的反应热数值会减小
D. 反应2NH3(g)![]() N2(g)+3H2(g)△H=+92kJ·mol﹣1
N2(g)+3H2(g)△H=+92kJ·mol﹣1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验事实能用平衡移动原理解释的是( )
A. 反应I2(g)+H2(g)![]() 2HI(g) 达平衡后,压缩体积体系颜色变深
2HI(g) 达平衡后,压缩体积体系颜色变深
B. H2O2中加入二氧化锰,生成氧气的速率加快
C. 棕黄色的FeCl3溶液中加入铁粉颜色逐渐变为浅绿色
D. 反应CO(g)+NO2(g)![]() CO2(g)+NO(g)△H<0,达平衡后,升高温度体系颜色变深
CO2(g)+NO(g)△H<0,达平衡后,升高温度体系颜色变深
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2019 年 5 月,香港理工大学宣布研发出超柔软高效能织物[柔性S/ HPCNF (分级多孔碳纳米纤维)]锂空气二次电池,在 S/ HPCNF 织物上均匀地沉积铜和镍,取代一般锂电池表面的金属箔, 以提高柔软度,电池的工作原理如图,下列有关说法错误的是

A.放电时,O2在阳极区发生氧化反应
B.沉积铜和镍是为了增强织物的导电性
C.充电时,Li+移向金属锂一极
D.充电时,阳极的电极反应为Li2O2-2e-=O2↑+2Li+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一水硫酸四氨合铜晶体[Cu(NH3)4SO4·H2O,相对分子质量为246]是一种重要的染料及农药中间体。常温下该物质可溶于水,难溶于乙醇。某化学兴趣小组通过以下实验制备一水硫酸四氨合铜晶体并测定其纯度。回答相关问题:
I.实验室制取CuSO4溶液
方案i:铜与浓硫酸加热制备。
方案ii:将铜粉在空气中充分加热至完全变黑,再加稀硫酸即可得到硫酸铜溶液。
(1)请写出方案i反应的化学方程式____,其缺点是____(写1点)。
(2)实际生产中方案ii常常有紫红色固体未反应,猜想原因可能是____。
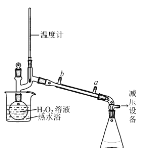
(3)基于此,实验进行了改进,其中一种方案是在硫酸和铜的反应容器中滴加H2O2溶液,观察到的现象是____(写1点)。H2O2的沸点为150.2℃。为加快反应需要提高H2O2溶液的浓度,可通过下图将H2O2稀溶液浓缩,冷水入口是____(填a或b),增加减压设备的目的是____。
II.一水硫酸四氨合铜晶体的制备
(4)硫酸铜溶液含有一定的硫酸,呈酸性,加入适量NH3·H2O调节溶液pH,产生浅蓝色沉淀,已知其成分为Cu2(OH)2SO4,试写出生成此沉淀的离子反应方程式__________。
(5)继续滴加NH3·H2O,会转化成深蓝色溶液。从深蓝色溶液中析出深蓝色晶体的简便实验是滴加____________。
III.产品纯度的测定
(6)精确称取mg晶体,加适量水溶解,然后逐滴加入足量NaOH溶液,通入水蒸气将氨全部蒸出,用V1mL0.200mol·L-1的盐酸完全吸收。以甲基橙作指示剂,用0.200mol·L-1NaOH标准溶液滴定过剩的HCl,到终点时消耗V2mLNaOH溶液。产品纯度的表达式为______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在恒温恒容的密闭体系中,可逆反应:A(s)+2B(g)![]() 2C(g) ΔH<0,不能作为该反应达到化学平衡的标志的是
2C(g) ΔH<0,不能作为该反应达到化学平衡的标志的是
①v正(B)=v逆(C) ②n(B)∶n(C)=1∶1 ③容器内压强不再改变
④容器内气体的密度不再改变 ⑤容器内混合气体的平均相对分子质量不再改变
A. ②③④⑤ B. ①③④ C. ②③ D. 全部
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将红热的固体单质M放入浓硝酸中,剧烈反应,产生混合气体A,A在常温下不与空气接触时,发生如图所示的变化。

(1)混合气体A的主要成分是____________。
(2)气体B为__________,蓝色溶液D为____________。
(3)单质M与浓硝酸反应的化学方程式是____________________________。
(4)单质C与稀硝酸反应的化学方程式是________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,隔板I固定不动,活塞Ⅱ可自由移动,M、N两个容器中均发生反应:A(g)+2B(g)![]() xC(g)△H=﹣192kJmol﹣1,向M、N中都通入1mol A和2mol B的混合气体,初始M、N容积相同,保持温度不变.下列说法正确的是( )
xC(g)△H=﹣192kJmol﹣1,向M、N中都通入1mol A和2mol B的混合气体,初始M、N容积相同,保持温度不变.下列说法正确的是( )

A. 若x=3,达到平衡后A的体积分数关系为:φ(M)>φ(N)
B. 若x>3,达到平衡后B的转化率关系为:α(M)>α(N)
C. 若x<3,C的平衡浓度关系为:c(M)>c(N)
D. x不论为何值,起始时向N容器中充入任意值的C,平衡后N容器中A的浓度均相等
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com