
��һ��������þ��ͭ�Ͻ���뵽ϡ������Һ�У�����ǡ����ȫ��Ӧ��������NO����4��48 L(��״��)����������Һ�м������ʵ���Ũ��Ϊ3 mol��L-1��NaOH��Һ��������ȫ���������й������в���ȷ����
| A����ʼ����Ͻ�����ʵ���֮��Ϊ0��3mol |
| B����Ӧ�б���ԭ��δ����ԭ���������ʵ���֮��Ϊ3��1 |
| C��������ȫʱ����NaOH��Һ�����Ϊ200mL |
| D�����ɳ�����������ԭ�Ͻ����������10��2g |
B
�������������A/��Mg��Cu�����ᷢ����Ӧʱ����ʧȥ���ӱ�ΪM2+�����ӣ�����õ����ӱ�ΪNO�����ݵ����غ�ɵ�2n(����)=3n(NO)=3��0��2=0��6mol/���Խ��������ʵ���Ϊ0��3mol����ȷ��B���ڷ�Ӧ�������������2����һ������������ã����ڽ��������ʵ���Ϊ0��3mol����������+2�۵Ľ����������������õ����ʵ���Ϊ0��6mol�������������õ���������ʵ���Ϊ0��2mol�����Է�Ӧ�б���ԭ��δ����ԭ���������ʵ���֮��Ϊ0��2��0��6= 1��3������C��n(M2+)=0��3mol������������Ӧ����NaOH�����ʵ���Ϊ0��3mol��2=0��6mol������V(NaOH)=0��6mol��3mol/L=0��2L=200ml����ȷ��D�����ɳ�����������ԭ�Ͻ���������ӵ���������OH-������������������Ӧ����NaOH�����ʵ���Ϊ0��3mol��2=0��6mol���������ӵ�����Ϊ0��6mol��17g/mol=10��2g����ȷ��
���㣺������������ᷢ����Ӧ�ĵ���ת�Ƽ��γɳ���ʱ��������ϵ��֪ʶ��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ���ѡ��
��ʯ�н�ĺ����ܵ�,����������൱�ȶ�,ֻ����ʪ��ұ�𡪡��軯������,������ϡ��NaCN��Һ�����ѷ���Ŀ�ʯ,�������Ľ������Һ��,Ȼ���ý���п����ԭ���������Һ���û��������䷴Ӧԭ��Ϊ
��4Au+8NaCN+O2+2H2O 4Na[Au(CN)2]+4NaOH;
4Na[Au(CN)2]+4NaOH;
��2Na[Au(CN)2]+Zn 2Au+Na2[Zn(CN)4]��
2Au+Na2[Zn(CN)4]��
�����й��軯���������˵������ȷ����( )
| A��Na[Au(CN)2]������ˮ |
| B��������Na[Au(CN)2]�н�Ԫ�صĻ��ϼ�Ϊ+1 |
| C����Ԫ���ڵؿ������Ի���̬����ʽ���� |
| D�������������к���Ԫ�ص�����ʼ���������� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ���ѡ��
���й��ڼס��ҡ��������ĸ�ͼ���˵���У���ȷ����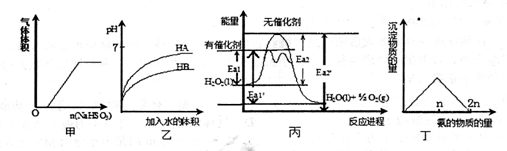
| A���������������Ʒ�ĩͶ��ϡ������Һ���й�ͼ�� |
| B�����ǵ�pH��HA��HB����������Һϡ��ʱpH�仯ͼ���ɴ˿�֪HA����������HB |
| C���ɱ���֪��˫��ˮ���д�������ʱ���Ȼ�ѧ����ʽΪ 2H2O2��1��="2H" 2O��l��+O2��g�� ��H=-2��Ea2����Ea2�� kJ��mol-l |
| D����������������Һ�еμӰ�ˮʱ�����������백�����ʵ����Ĺ�ϵͼ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ���ѡ��
������ˮ�е�NH4����һ�������¿���O2�������·�Ӧ��
��NH4��(aq) + 3/2O2(g) = NO2��(aq) + 2H��(aq) + H2O(l) ��H = -273kL/mol
��NO2��(aq) + 1/2O2(g) = NO3��(aq) ��H = -73kL/mol
������������ȷ����
| A�������¶ȣ���ʹ�٢ڷ�Ӧ���ʾ��ӿ� |
| B��������ʱ0.1 mol/L HNO2(aq) pH��1����NaNO2��Һ�Լ��� |
| C��NH4+(aq) + 2O2(g) = NO3 -(aq) + 2H+(aq) + H2O(l)��H = -346kJ/mol |
| D��1 mol NH4���ڢٷ�Ӧ����1 mol NO2���ڢڷ�Ӧ��ʧ������֮��Ϊ1:3 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ���ѡ��
��Fe3+��Fe2+��NO3����NH4+��H+��H2O���������ֱ�����һ��������ԭ��Ӧ�еķ�Ӧ�����������������У�����ȷ����
| A����ԭ����ΪNH4+ |
| B���������뻹ԭ�������ʵ���֮��Ϊ1��8 |
| C������0.5mol NO3���μӻ�ԭ��Ӧ����ת�Ƶ���8mol |
| D�����Ѹ÷�Ӧ���Ϊ���أ���������ӦΪFe2+��e��Fe3+ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ���ѡ��
FeS��һ��Ũ�ȵ�HNO3��Ӧ������Fe(NO3)3��Fe2(SO4)3��NO2��N2O4��NO��H2O����NO2��N2O4��NO�����ʵ���֮��Ϊ1:1:1ʱ��ʵ�ʲμӷ�Ӧ��FeS��HNO3�����ʵ���֮��Ϊ
| A��1:6 |
| B��2:15 |
| C��2:11 |
| D��1:7 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ���ѡ��
������������ȷ����
| A��Li+�к��е��������������֮��Ϊ2�U1 |
| B����C2H6�����м��Թ��ۼ���Ǽ��Թ��ۼ���֮��Ϊ6�U1 |
| C�������£�11.2 L�ļ��������к��е��⡢̼ԭ����֮��Ϊ4�U1 |
| D��5.6 g����������������Ӧʧȥ�ĵ�������뷴Ӧ���������ʵ���֮��Ϊ2�U1 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ���ѡ��
����Ϊ���ܻ�ԭ����NaBH4����ˮ����ˮ��Ӧ��NaBH4��2H2O=NaBO2��4H2��������˵������ȷ����(NaBH4��HΪ��1��)
| A��NaBH4�������������ǻ�ԭ�� |
| B��NaBH4����������H2O�ǻ�ԭ�� |
| C����Ԫ�ر���������Ԫ�ر���ԭ |
| D����������Ԫ���뱻��ԭ��Ԫ������֮��Ϊ1��1 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ���ѡ��
��֪���з�Ӧ��Co2O3��6HCl(Ũ)=2CoCl2��Cl2����3H2O(��)��5Cl2��I2��6H2O=10HCl��2HIO3(��)������˵����ȷ���� (����)��
| A����Ӧ����HCl�������� |
| B����Ӧ����Cl2����������Ӧ |
| C����ԭ�ԣ�CoCl2��HCl��I2 |
| D�������ԣ�Co2O3��Cl2��HIO3 |
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com