
【题目】某兴趣小组同学欲研究SO2的相关性质。
(1)比较下表中的两组物质关系,第2组中物质X的化学式是 。
第1组 | 第2组 |
C、CO、CO2、H2CO3、Na2CO3、、NaHCO3、 | S 、SO2、SO3、X、Na2SO4、NaHSO4 |
(2)利用下图装置来检验SO2的性质
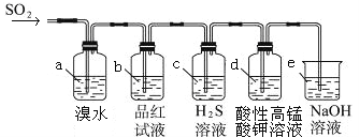
①装置a中的现象是: ; (填“能”或“不能”)说明SO2有漂白性
②若装置e中有40 mL 2.5 molL-1 NaOH溶液,反应后增重4.8 g,则装置IV中发生反应的总化学方程式是 。
(3)该小组的甲、乙两位同学利用下图装置继续探究SO2及氯气漂白性:

通气一段时间后,甲同学实验过程中品红溶液几乎不褪色,而乙同学的实验现象是品红溶液随时间的推移变得越来越浅。试根据该实验装置和两名同学的实验结果回答问题。
①试分析甲同学实验过程中,用离子方程式表示品红溶液不褪色的原因是: 。
②你认为乙同学是怎样做到让品红溶液变得越来越浅的?
【答案】
(1)H2SO4
(2)①溴水褪色,不能;②3SO2+4NaOH==Na2SO3+2NaHSO3+H2O
(3)①SO2+Cl2+2H2O=SO42-+2Cl—+4H+
②控制SO2和Cl2进气的物质的量,使之不相等
【解析】
试题分析:(1)第一组中碳元素的化合价依次升高,最后变成酸、正盐、酸式盐、依次低组中硫元素的化合价升高到+6价,故X为硫酸,故答案为:H2SO4;
(2)①二氧化硫具有还原性,溴水具有氧化性,发生氧化还原反应,溴水褪色,不能说明 SO2有漂白性,故答案为:溴水褪色,不能;
②若n(SO2):n(NaOH)=1:2反应按照反应:SO2+2NaOH═Na2SO3+H2O;若n(SO2):n(NaOH)=1:1,反应按照反应SO2+NaOH═NaHSO3;装置Ⅳ中有40mL 2.5molL-1 NaOH溶液中n(NaOH)=0.1mol,n(SO2)=![]() =0.075mol;n(SO2):n(NaOH)=0.075:0.1=3:4,所以生成产物为亚硫酸钠和亚硫酸氢钠;设生成亚硫酸钠xmol、亚硫酸氢钠ymol,则:x+y=0.075,2x+y=0.1,解得:x=0.025,y=0.05,即n(Na2SO3):n(NaHSO3)=1:2,所以反应的化学方程式为:3SO2+4NaOH═Na2SO3+2NaHSO3+H2O,故答案为:3SO2+4NaOH═Na2SO3+2NaHSO3+H2O;
=0.075mol;n(SO2):n(NaOH)=0.075:0.1=3:4,所以生成产物为亚硫酸钠和亚硫酸氢钠;设生成亚硫酸钠xmol、亚硫酸氢钠ymol,则:x+y=0.075,2x+y=0.1,解得:x=0.025,y=0.05,即n(Na2SO3):n(NaHSO3)=1:2,所以反应的化学方程式为:3SO2+4NaOH═Na2SO3+2NaHSO3+H2O,故答案为:3SO2+4NaOH═Na2SO3+2NaHSO3+H2O;
(3)①氯气和二氧化硫在水溶液中恰好完全反应:Cl2+SO2+2H2O═2HCl+H2SO4,生成的硫酸和盐酸不具有漂白性,所以品红溶液不褪色,故答案为:Cl2+SO2+2H2O═2HCl+H2SO4;②当通入的二氧化硫或者氯气一方有剩余时,有具有漂白性,使品红褪色,故答案为:控制SO2和Cl2进气的物质的量,使之不相等。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】电浮选凝聚法是工业上采用的一种污水处理方法,即保持污水的pH在5.0~6.0之间,通过电解生成Fe(OH)3胶体,Fe(OH)3胶体具有吸附作用,可吸附水中的污物而使其沉淀下来,起到净水的作用,其原理如图所示。下列说法正确的是

A.石墨电极上发生氧化反应
B.根据图示,物质A为CO2
C.为增强污水的导电能力,可向污水中加入适量乙醇
D.甲烷燃料电池中CO32-向空气一极移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.化学反应的焓变与反应的途径有关
B.室温下,稀释0.1mol·L-1CH3COOH溶液,溶液的导电能力减弱
C.常温常压下,22.4L Cl2中含有的分子数为6.02×1023个
D.等质量的铜按a、b两种途径完全转化为Cu(NO3)2,途径a、b消耗的硝酸一样多

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关实验现象和解释或结论都正确的是
选项 | 实验操作 | 实验现象 | 解释或结论 |
A | 将充满NO2的密闭玻璃球浸泡在热水中 | 红棕色变深 | 反应2NO |
B | 将少量的溴水分别滴入FeCl2溶液、NaI溶液中,再分别滴加CCl4振荡 | 下层分别呈无 色和紫红色 | 还原性:I->Br->Fe2+ |
C | 某钾盐溶于盐酸,产生无色无味气体,通过澄清石灰水 | 有白色沉淀出现 | 该钾盐是K2CO3 |
D | 把SO2通入紫色石蕊试液中 | 紫色褪去 | SO2具有漂白性 |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将等物质的量A、B混合于2 L的密闭容器中,发生如下反应:![]() ,经5 min后,测得D的浓度为0.5 molL-1,
,经5 min后,测得D的浓度为0.5 molL-1,![]() ,
,
C的平均反应速率是0.1 molL-1min-1
求:(1)此时A的浓度及反应开始前放入容器中A、B物质的量。
(2)B的平均反应速率。
(3)x值是多少?
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】组成小麦的主要元素是( )
A. C、H、Ca、K、Mg、B
B. N、P、S、Zn、Cu、Mn
C. C、H、O、P、S、N
D. H、O、Fe、B、Zn、Mg
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,在体积为10 L的密闭容器中,1 mol X和1 mol Y进行如下反应:2X(g) + Y(g) ![]() Z(g),经60 s达到平衡,生成0.3 mol Z,下列说法正确的是( )
Z(g),经60 s达到平衡,生成0.3 mol Z,下列说法正确的是( )
A.达到平衡时X浓度为0.04 mol/L
B.将容器体积变为20 L,Z的平衡浓度变为0.015mol/L
C.若增大压强,平衡向正方向移动,平衡常数变大
D.若升高温度,X的体积分数增大,则该反应的H>0
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com