
ЎҫМвДҝЎҝОнцІСПЦШОЈәҰИЛАаҪЎҝөәНЙъМ¬»·ҫіЈ¬ҝӘ·ўОИ¶ЁёЯР§өДНСБтНСПх№ӨТХјјКхКЗ№ъДЪНвСРҫҝөДИИөгЎЈСРҫҝұнГчЈ¬өӘСх»ҜОп(NOx)әН¶юСх»ҜБтФЪРОіЙОнцІКұУлҙуЖшЦРөД°ұУР№ШЈ¬ЖдЧӘ»Ҝ№ШПөИзПВНјЛщКҫЎЈ

(1)NH3өДөзЧУКҪКЗ_________ЎЈ
(2)NH4NO3ИЬТәЦРөДАлЧУЕЁ¶ИУЙҙуөҪРЎЛіРтКЗ_________ЎЈ
(3)ўЩТСЦӘЈәSO2ЙъіЙSO3ЧЬ·ҙУҰ·ҪіМКҪКЗ
2SO2(g)Ј«O2(g) ![]() 2SO3(g) ҰӨHЈҪЈӯ196.6 kJ/mol
2SO3(g) ҰӨHЈҪЈӯ196.6 kJ/mol
ҙЛ·ҙУҰҝЙНЁ№эИзПВБҪІҪНкіЙЈә
2NO(g)Ј«O2 (g ) ![]() 2NO2(g) ҰӨH1ЈҪЈӯ113 kJ/mol
2NO2(g) ҰӨH1ЈҪЈӯ113 kJ/mol
NO2(g)Ј«SO2(g) ![]() SO3(g)Ј«NO(g) ҰӨH2ЈҪ_________ЎЈ
SO3(g)Ј«NO(g) ҰӨH2ЈҪ_________ЎЈ
ўЪ Т»¶ЁОВ¶ИПВЈ¬Пт2 LәгИЭГЬұХИЭЖчЦРідИлNO2әНSO2ёч1 molЈ¬5minҙпөҪЖҪәвЈ¬ҙЛКұИЭЖчЦРNO2әНNOөДЕЁ¶ИЦ®ұИОӘ1ЎГ3Ј¬ФтNO2өДЖҪәвЧӘ»ҜВККЗ_________ЎЈ
(4)АыУГNaClO2/H2O2ЛбРФёҙәПОьКХјБҝЙН¬КұУРР§НСБтЎўНСПхЎЈ
ўЩ ЦЖұёЙЩБҝNaClO2Ј¬ЖдЧ°ЦГИзПВНјЛщКҫЈә

Ч°ЦГIҝШЦЖОВ¶ИФЪ35~55ЎжЈ¬НЁИлSO2Ҫ«NaClO3»№ФӯОӘClO2(·РөгЈә11Ўж)Ј¬·ҙУҰөДАлЧУ·ҪіМКҪКЗ_____________________________________________Ј¬
Ч°ЦГўтЦР·ҙУҰЙъіЙNaClO2Ј¬ҙЛ·ҙУҰЦРЧчОӘСх»ҜјБөДКЗ_______________Ј¬·ҙУҰәуИЬТәЦРТхАлЧУіэБЛClO2ЈӯЎўClO3ЈӯЎўClЈӯЎўClOЈӯЎўOHЈӯНв»№ҝЙДЬә¬УРөДТ»ЦЦТхАлЧУКЗ_______________ЎЈ
ўЪ УГЦЖөГөДNaClO2/H2O2ЛбРФёҙәПОьКХјБН¬Кұ¶ФNOЎўSO2ҪшРРСх»ҜөГөҪПхЛбәНБтЛб¶шіэИҘЎЈФЪОВ¶ИТ»¶ЁКұЈ¬n(H2O2)/n(NaClO2)ЎўИЬТәpH¶ФНСБтНСПхөДУ°ПмИзПВНјЛщКҫЈә


ҙУЙПНјЦРҝЙЦӘНСБтНСПхЧојСМхјюКЗ_________ЎЈНј ЦРSO2өДИҘіэВКЛжpHөДФцҙу¶шФцҙ󣬶шNO өДИҘіэВКФЪpH>5.5Кұ·ҙ¶шјхРЎЈ¬ЗлҪвКНNOИҘіэВКјхРЎөДҝЙДЬФӯТтКЗ______________________________ЎЈ
Ўҫҙр°ёЎҝ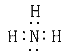 c(NO3-) > c(NH4+) > c(H+) > c(OHЎӘ) ЎӘ41.8 kJ/mol 75% SO2+2ClO3ЎӘ===2ClO2+SO42- ClO2 SO42- pHФЪ5.5~6.0 n(H2O2)/n(NaClO2) = 6 Јә1 ФӯТтЈәpH>5.5ТФәуЈ¬ЛжЧЕpHФцҙуЈ¬NOөД»№ФӯРФҪөөНЈ»»тH2O2әНNaClO2Сх»ҜРФјхИхЈ¬І»ДЬҪ«NOСх»ҜОӘПхЛб
c(NO3-) > c(NH4+) > c(H+) > c(OHЎӘ) ЎӘ41.8 kJ/mol 75% SO2+2ClO3ЎӘ===2ClO2+SO42- ClO2 SO42- pHФЪ5.5~6.0 n(H2O2)/n(NaClO2) = 6 Јә1 ФӯТтЈәpH>5.5ТФәуЈ¬ЛжЧЕpHФцҙуЈ¬NOөД»№ФӯРФҪөөНЈ»»тH2O2әНNaClO2Сх»ҜРФјхИхЈ¬І»ДЬҪ«NOСх»ҜОӘПхЛб
ЎҫҪвОцЎҝ
ұҫМвОӘЧЫәПМвЎЈ
ЈЁ1Ј©өӘФӯЧУУлЗвФӯЧУКЗНЁ№э№ІУГөзЧУ¶ФПаҪбәПРОіЙ°ұЖшЈ¬ЖдЦРә¬УР3ёц№ІјЫјьЈ¬өзЧУКҪОӘ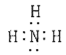 Ј»
Ј»
ЈЁ2Ј©ҙЛРЎМвҝјІйөДКЗСОАаөДЛ®ҪвЈ¬NH4NO3ИЬОӘЗҝЛбИхјоСОЈ¬ФЪЛ®ЦР·ўЙъЛ®ҪвЈ¬ИЬТәПФЛбРФЈ¬ФтПхЛбёщАлЧУөДЕЁ¶ИҙуУЪп§ёщАлЧУөДЕЁ¶ИЈ¬ЗвАлЧУөДЕЁ¶ИҙуУЪЗвСхёщАлЧУөДЕЁ¶ИЈ»
ЈЁ3Ј©ўЩҙЛРЎМвҝјІйөДКЗёЗЛ№¶ЁВЙөДФЛУГЈ¬2ёцNO2(g)Ј«SO2(g) ![]() SO3(g)Ј«NO(g) өИУЪЧЬ·ҙУҰ2SO2(g)Ј«O2(g)
SO3(g)Ј«NO(g) өИУЪЧЬ·ҙУҰ2SO2(g)Ј«O2(g) ![]() 2SO3(g) јхИҘЖдЦРөДТ»ёц·ҙУҰ2NO(g)Ј«O2 (g )
2SO3(g) јхИҘЖдЦРөДТ»ёц·ҙУҰ2NO(g)Ј«O2 (g ) ![]() 2NO2(g)Ј»
2NO2(g)Ј»
ўЪұҫРЎМвҝјІйөДКЗИэ¶ОКҪҪвМвөДФЛУГЈ»
ЈЁ4Ј©ўЩҙЛРЎМвҝјІйөДКЗСх»Ҝ»№Фӯ·ҙУҰ·ҪіМКҪөДКйРҙЈ¬ПИёщҫЭјЫМ¬ЙэҪөХТіцСх»ҜјБЎў»№ФӯјБЎўСх»ҜІъОпЎў»№ФӯІъОпЈ¬ФЩёщҫЭөГК§өзЧУКШәгЕдЖҪАлЧУ·ҪіМКҪSO2+2ClO3ЎӘ===2ClO2+SO42-Ј»ҙЛНв»№ҝјІйБЛСх»ҜјБөДЕР¶ПЈ¬Сх»ҜјБКЗФӘЛШ»ҜәПјЫҪөөНөГөзЧУ·ўЙъ»№Фӯ·ҙУҰөДОпЦКЈ»
ўЪёщҫЭЧуНјNO2өДНСіэВКФЪn(H2O2)/n(NaClO2) = 6 Јә1КұР§№ыЧоәГЈ¬ҙуУЪ6:1ТФәуұд»ҜІ»ҙуЈ¬ёщҫЭУТНјNO2өДНСіэВКФЪpHОӘ5.5~6.0КұР§№ыЧоәГЈ¬ҙуУЪ6.0ТФәу·ҙ¶шјхРЎЈ¬ФтБтНСПхЧојСМхјюКЗpHФЪ5.5~6.0 n(H2O2)/n(NaClO2) = 6 Јә1Ј»SO2өДИҘіэВКЛжpHөДФцҙу¶шФцҙ󣬶шNO өДИҘіэВКФЪpH>5.5Кұ·ҙ¶шјхРЎКЗТтОӘpH>5.5ТФәуЈ¬ЛжЧЕpHФцҙуЈ¬NOөД»№ФӯРФҪөөНЈ»»тH2O2әНNaClO2Сх»ҜРФјхИхЈ¬І»ДЬҪ«NOСх»ҜОӘПхЛбЎЈ
ЈЁ1Ј©өӘФӯЧУЧоНвІгУР5ёцөзЧУЈ¬ҙпөҪ8өзЧУОИ¶ЁҪб№№РиөГ3ёцөзЧУЈ¬ЗвФӯЧУЧоНвІг1ёцөзЧУЈ¬ҙпөҪ2өзЧУОИ¶ЁҪб№№РиөГТ»ёцөзЧУЈ¬ФтөӘФӯЧУәН3ёцЗвФӯЧУҝЙРОіЙ3¶Ф№ІУГөзЧУ¶ФЈ¬өзЧУКҪОӘ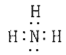 ЎЈұҫРЎМвҙр°ёОӘЈә
ЎЈұҫРЎМвҙр°ёОӘЈә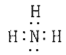 ЎЈ
ЎЈ
ЈЁ2Ј©NH4NO3ИЬОӘЗҝЛбИхјоСОЈ¬ФЪЛ®ЦР·ўЙъЛ®ҪвЈ¬ИЬТәПФЛбРФЈ¬ФтАлЧУЕЁ¶ИУЙҙуөҪРЎЛіРтКЗc(NO3-) > c(NH4+) > c(H+) > c(OHЎӘ)ЎЈұҫРЎМвҙр°ёОӘЈәc(NO3-) > c(NH4+) > c(H+) > c(OHЎӘ)ЎЈ
ЈЁ3Ј©ўЩёщҫЭёЗЛ№¶ЁВЙ2ёцNO2(g)Ј«SO2(g) ![]() SO3(g)Ј«NO(g) өИУЪЧЬ·ҙУҰ2SO2(g)Ј«O2(g)
SO3(g)Ј«NO(g) өИУЪЧЬ·ҙУҰ2SO2(g)Ј«O2(g) ![]() 2SO3(g) јхИҘЖдЦРөДТ»ёц·ҙУҰ2NO(g)Ј«O2 (g )
2SO3(g) јхИҘЖдЦРөДТ»ёц·ҙУҰ2NO(g)Ј«O2 (g ) ![]() 2NO2(g) Ј¬Фт2(-ҰӨH2)ЈҪҰӨH-ҰӨH1ЈҪЈӯ196.6 kJ/mol-ЈЁЈӯ113 kJ/molЈ©=-83.6 kJ/molЈ¬ФтҰӨH2ЈҪ-41.8 kJ/molЎЈұҫРЎМвҙр°ёОӘЈә-41.8 kJ/molЎЈ
2NO2(g) Ј¬Фт2(-ҰӨH2)ЈҪҰӨH-ҰӨH1ЈҪЈӯ196.6 kJ/mol-ЈЁЈӯ113 kJ/molЈ©=-83.6 kJ/molЈ¬ФтҰӨH2ЈҪ-41.8 kJ/molЎЈұҫРЎМвҙр°ёОӘЈә-41.8 kJ/molЎЈ
ўЪ
NO2(g)Ј«SO2(g) ![]() SO3(g)Ј«NO(g)
SO3(g)Ј«NO(g)
ЖрКјЕЁ¶ИЈЁmol/LЈ© 0.5 0.5 0 0
ұд»ҜЕЁ¶ИЈЁmol/LЈ© x x x x
ЖҪәвЕЁ¶ИЈЁmol/LЈ© 0.5-x 0.5-x x x
ёщҫЭМвТвЈЁ0.5-xЈ©/x=1:3 x=0.375 NO2өДЖҪәвЧӘ»ҜВКОӘ(0.375/0.5)ЎБ100%=75%ЎЈұҫРЎМвҙр°ёОӘЈә75%ЎЈ
ЈЁ4Ј©ўЩЧ°ЦГIҝШЦЖОВ¶ИФЪ35~55ЎжЈ¬НЁИлSO2Ҫ«NaClO3»№ФӯОӘClO2(·РөгЈә11Ўж)Ј¬SO2ЦРөДБтФӘЛШөД»ҜәПјЫУЙ+4јЫЙэёЯөҪ+6јЫұ»Сх»ҜОӘSO42-Ј¬ NaClO3ЦРВИФӘЛШөД»ҜәПјЫУЙ+5јЫҪөөНөҪ+4јЫұ»»№ФӯОӘClO2Ј¬АлЧУ·ҪіМКҪОӘSO2+2ClO3ЎӘ===2ClO2+SO42-Ј»Ч°ЦГIЦРІъЙъөДClO2ҫӯөј№ЬҪшИлЧ°ЦГўтЙъіЙNaClO2Ј¬ClO2ЦРВИФӘЛШөД»ҜәПјЫУЙ+4јЫҪөөНөҪ+3јЫЈ¬·ўЙъ»№Фӯ·ҙУҰЈ¬ClO2ОӘСх»ҜјБЈ»Ч°ЦГIЦРНЁИлSO2өДІ»НкИ«·ҙУҰЈ¬ФЪЧ°ЦГўтЦРұ»Сх»ҜЙъіЙБтЛбЈ¬ИЬТәЦРҝЙДЬҙжФЪSO42-Ј»ұҫРЎМвҙр°ёОӘЈәO2+2ClO3ЎӘЈҪ2ClO2+SO42-Ј» ClO2Ј»SO42-ЎЈ
ўЪёщҫЭЧуНјNO2өДНСіэВКФЪn(H2O2)/n(NaClO2) = 6 Јә1КұР§№ыЧоәГЈ¬ҙуУЪ6:1ТФәуұд»ҜІ»ҙуЈ¬ёщҫЭУТНјNO2өДНСіэВКФЪpHОӘ5.5~6.0КұР§№ыЧоәГЈ¬ҙуУЪ6.0ТФәу·ҙ¶шјхРЎЈ¬ФтБтНСПхЧојСМхјюКЗ pHФЪ5.5~6.0 n(H2O2)/n(NaClO2) = 6 Јә1Ј»SO2өДИҘіэВКЛжpHөДФцҙу¶шФцҙ󣬶шNO өДИҘіэВКФЪpH>5.5Кұ·ҙ¶шјхРЎКЗТтОӘpH>5.5ТФәуЈ¬ЛжЧЕpHФцҙуЈ¬NOөД»№ФӯРФҪөөНЈ»»тH2O2әНNaClO2Сх»ҜРФјхИхЈ¬І»ДЬҪ«NOСх»ҜОӘПхЛбЎЈұҫРЎМвҙр°ёОӘЈәpHФЪ5.5~6.0 n(H2O2)/n(NaClO2) = 6 Јә1Ј»pH>5.5ТФәуЈ¬ЛжЧЕpHФцҙуЈ¬NOөД»№ФӯРФҪөөНЈ»»тH2O2әНNaClO2Сх»ҜРФјхИхЈ¬І»ДЬҪ«NOСх»ҜОӘПхЛбЎЈ


 ФД¶БҝміөПөБРҙр°ё
ФД¶БҝміөПөБРҙр°ё
| Дкј¶ | ёЯЦРҝОіМ | Дкј¶ | іхЦРҝОіМ |
| ёЯТ» | ёЯТ»Гв·СҝОіМНЖјцЈЎ | іхТ» | іхТ»Гв·СҝОіМНЖјцЈЎ |
| ёЯ¶ю | ёЯ¶юГв·СҝОіМНЖјцЈЎ | іх¶ю | іх¶юГв·СҝОіМНЖјцЈЎ |
| ёЯИэ | ёЯИэГв·СҝОіМНЖјцЈЎ | іхИэ | іхИэГв·СҝОіМНЖјцЈЎ |
ҝЖДҝЈәёЯЦР»ҜС§ АҙФҙЈә МвРНЈә
ЎҫМвДҝЎҝДіРЈС§ЙъҝОНв»о¶ҜРЎЧйөДН¬С§ЙијЖПВНјЛщКҫКөСйЧ°ЦГЈ¬УГАҙСйЦӨТ»Сх»ҜМјҫЯУР»№ФӯРФЈ¬»ШҙрПВБРОКМвЈә

(1)РҙіцЧ°ЦГAЦРЛщ·ўЙъ·ҙУҰөДАлЧУ·ҪіМКҪЈә__________ЎЈ
(2)Ч°ЦГBЦРЧоККТЛөДКФјБКЗ_________________ЎЈ
(3)ИфКөСйЦРГ»УРЧ°ЦГCЈ¬К№Ч°ЦГBУлЧ°ЦГDЦұҪУПаБ¬Ј¬»б¶ФКөСйФміЙөДУ°ПмКЗ_______ЎЈ
(4)ёщҫЭКөСйЦРөД___________________ПЦПуЈ¬ҝЙЦӨГчCOҫЯУР»№ФӯРФЎЈ
(5)ИфТӘёщҫЭЧ°ЦГFЦРіОЗеКҜ»ТЛ®ұд»лЧЗөДПЦПуИ·ИПТ»Сх»ҜМјҫЯУР»№ФӯРФЈ¬УҰФЪЙПНјЧ°ЦГ________Ул______Ц®јдБ¬ҪУПВНјЦРөД________Ч°ЦГ(МоРтәЕ)ЎЈ

Ійҝҙҙр°ёәНҪвОц>>
ҝЖДҝЈәёЯЦР»ҜС§ АҙФҙЈә МвРНЈә
ЎҫМвДҝЎҝLiAlH4КЗҪрКфҙўЗвІДБПЈ¬УцЛ®ҫзБТ·ҙУҰКН·ЕіцH2Ј¬LiAlH4ФЪ125ЎжКұ·ЦҪвОӘLiHЎўH2әНAlЎЈПВБРЛө·ЁХэИ·өДКЗЈЁ Ј©
A.LiAlH4ЦРAlөД»ҜәПјЫОӘ-5јЫ
B.LiAlH4УлЛ®·ҙУҰКұЈ¬LiAlH4Чч»№ФӯјБ
C.LiAlH4ФЪ125ЎжКұНкИ«·ЦҪвЈ¬ГҝЙъіЙ2mol H2Ј¬ЧӘТЖөзЧУКэ2NAёц
D.LiHКЗ·ҙУҰөД»№ФӯІъОп
Ійҝҙҙр°ёәНҪвОц>>
ҝЖДҝЈәёЯЦР»ҜС§ АҙФҙЈә МвРНЈә
ЎҫМвДҝЎҝПВБРКөСйЦРөДСХЙ«ұд»ҜЈ¬УлСх»Ҝ»№Фӯ·ҙУҰОЮ№ШөДКЗ
A | B | C | D | |
КөСй | РВЦЖВИЛ®өОИлNa2S ИЬТәЦР | ТТҙјөОИлK2Cr2O7ЛбРФИЬТәЦР | ұҘәНFeCl3ИЬТәөОИл·РЛ®ЦР | ІЭЛбөОИлKMnO4 ЛбРФИЬТәЦР |
ПЦПу | ІъЙъ»ЖЙ«»лЧЗ | ИЬТәУЙіИЙ«ұдОӘВМЙ« | ТәМеұдОӘәмәЦЙ«ЗТіОЗеНёГч | ІъЙъОЮЙ«ЖшМеЈ¬ИЬТәЧПәмЙ«НКИҘ |
A. AB. BC. CD. D
Ійҝҙҙр°ёәНҪвОц>>
ҝЖДҝЈәёЯЦР»ҜС§ АҙФҙЈә МвРНЈә
ЎҫМвДҝЎҝКөСйРЎЧйМҪҫҝВБЖ¬Чцөзј«ІДБПКұөДФӯөзіШ·ҙУҰЈ¬КөСйИзПВЈә
ўЩ | ўЪ | ўЫ |
|
|
Цу·РАдИҙәуөДИЬТә |
өзБчјЖЦёХлПтУТЖ«ЧӘЈ¬ГҫЖ¬ЎўВБЖ¬ұнГжІъЙъОЮЙ«ЖшЕЭ | өзБчјЖЦёХлСёЛЩПтУТЖ«ЧӘЈ¬ЦрҪҘПтБгҝМ¶И»ЦёҙЈ¬ҫӯБгҝМ¶ИәујМРшПтЧуЖ«ЧӘЈ»ГҫЖ¬ұнГжҝӘКјКұОЮГчПФПЦПуЈ¬Т»¶ОКұјдәуУРЙЩБҝЖшЕЭТЭіцЈ»ВБЖ¬ұнГжіЦРшУРЖшЕЭТЭіцЎЈ | өзБчјЖЦёХлПтЧуЖ«ЧӘЎЈВБЖ¬ұнГжУРЖшЕЭТЭіцЈ¬НӯЖ¬Г»УРГчПФПЦПуЈ»Фј3·ЦЦУәуЈ¬НӯЖ¬ұнГжУРЙЩБҝЖшЕЭІъЙъЈ¬ВБЖ¬ұнГжЖшЕЭВФУРјхЙЩЎЈ |
ПВБРЛө·ЁІ»ХэИ·өДКЗ
A. КөСйўЩЦРЈ¬ГҫЖ¬ЧцФӯөзіШөДёәј«
B. КөСйўЪЦРЈ¬іхКјКұөДКөСйПЦПу¶ФУҰөДФӯөзіШ·ҙУҰОӘЈә2Mg + O2 + 2H2O ![]() 2Mg( OH) 2
2Mg( OH) 2
C. КөСйўЪЦРЈ¬Т»¶ОКұјдәуЈ¬ВБЖ¬·ўЙъөДөзј«·ҙУҰКҪОӘЈәAl - 3 e - ![]() Al 3+
Al 3+
D. КөСйўЩ ~ ўЫҝЙНЖЦӘЈ¬ВБЖ¬Чцөзј«ІДБПКұөДФӯөзіШ·ҙУҰУлБнТ»ёцөзј«өДөзј«ІДБПЎўИЬТәөДЛбјоРФЎўИЬТәЦРИЬҪвөДO2өИТтЛШУР№Ш
Ійҝҙҙр°ёәНҪвОц>>
ҝЖДҝЈәёЯЦР»ҜС§ АҙФҙЈә МвРНЈә
ЎҫМвДҝЎҝДіН¬С§ФЪКөСйКТҪшРРМъСОУлСЗМъСОПа»ҘЧӘ»ҜКөСйЎЈ
КөСйўсЈәҪ«Fe3+ЧӘ»ҜОӘFe2+

(1)Fe3+УлCu·Ы·ўЙъ·ҙУҰөДАлЧУ·ҪіМКҪОӘ_________________________________ЎЈ
(2)ДіС§ЙъУГ¶ФұИКөСй·ЁМҪҫҝ°ЧЙ«іБөнІъЙъөДФӯТтЈ¬ЗлМоРҙКөСйНт°ёЈә
КөСй·Ҫ°ё | ПЦПу | ҪбВЫ |
ІҪЦи1ЈәИЎ4mLўЩ__________ mol/LCuSO4ИЬТә,ПтЖдЦРөОјУ3өО0.1mol/LKSCNИЬТә | ІъЙъ°ЧЙ«іБөн | CuSO4ИЬТәУлKSCNИЬТә·ҙУҰІъЙъБЛ°ЧЙ«іБөн |
ІҪЦи2ЈәИЎ4mLўЪ__________mol/LFeSO4 ИЬТәПтЖдЦРөОјУ3өО0.1mol/LKSCNИЬТә | ОЮГчПФПЦПу |
ІйФДЧКБПЈә
ТСЦӘўЩSCN-өД»ҜС§РФЦКУлI-ПаЛЖ ўЪ2Cu2++4I-=2CuIЎэ+I2
Cu2+УлSCN-·ҙУҰөДАлЧУ·ҪіМКҪОӘўЫ___________________________________ЎЈ
КөСйўтЈәҪ«Fe2+ЧӘ»ҜОӘFe3+
КөСй·Ҫ°ё | ПЦПу |
Пт3mL0.1mol/LFeSO4ИЬТәЦРјУИл 3mL0.5mol/LПЎПхЛб | ИЬТәұдОӘЧШЙ«Ј¬·ЕЦГТ»¶ОКұјдәуЈ¬ЧШЙ«ПыК§Ј¬ИЬТәұдОӘ»ЖЙ« |
МҪҫҝЙПКцПЦПуіцПЦөДФӯТтЈә
ІйФДЧКБПЈәFe2++NO![]() Fe(NO)2+(ЧШЙ«)
Fe(NO)2+(ЧШЙ«)
(3)УГАлЧУ·ҪіМКҪҪвКНNOІъЙъөДФӯТт___________________________________ЎЈ
(4)ҙУ»ҜС§·ҙУҰЛЩВКУлПЮ¶ИөДҪЗ¶И¶ФМеПөЦРҙжФЪөД·ҙУҰҪшРР·ЦОцЈә
·ҙУҰўсЈәFe2+УлHNO3·ҙУҰЈ»·ҙУҰўтЈәFe2+УлNO·ҙУҰ
ўЩ·ҙУҰўсКЗТ»ёцІ»ҝЙДж·ҙУҰЈ¬ЙијЖКөСй·Ҫ°ёјУТФЦӨГч_____________________________ЎЈ
ўЪЗлУГ»ҜС§ЖҪәвТЖ¶ҜФӯАнҪвКНИЬТәУЙЧШЙ«ұдОӘ»ЖЙ«өДФӯТт_____________________________ЎЈ
Ійҝҙҙр°ёәНҪвОц>>
ҝЖДҝЈәёЯЦР»ҜС§ АҙФҙЈә МвРНЈә
ЎҫМвДҝЎҝТСЦӘЗҰРоөзіШөД№ӨЧчФӯАнОӘPbЈ«PbO2Ј«2H2SO4![]() 2PbSO4Ј«2H2OЈ¬ПЦУГИзНјЧ°ЦГҪшРРөзҪв(өзҪвТәЧгБҝ)Ј¬ІвөГөұЗҰРоөзіШЦРЧӘТЖ0.4 molөзЧУКұМъөзј«өДЦКБҝјхЙЩ11.2 gЎЈЗл»ШҙрПВБРОКМвЎЈ
2PbSO4Ј«2H2OЈ¬ПЦУГИзНјЧ°ЦГҪшРРөзҪв(өзҪвТәЧгБҝ)Ј¬ІвөГөұЗҰРоөзіШЦРЧӘТЖ0.4 molөзЧУКұМъөзј«өДЦКБҝјхЙЩ11.2 gЎЈЗл»ШҙрПВБРОКМвЎЈ

ЈЁ1Ј©AКЗЗҰРоөзіШөД___________ј«Ј¬ЗҰРоөзіШХэј«·ҙУҰКҪОӘ___________Ј¬·Еөз№эіМЦРөзҪвТәөДГЬ¶И___________ (МоЎ°јхРЎЎұЎўЎ°ФцҙуЎұ»тЎ°І»ұдЎұ)ЎЈ
ЈЁ2Ј©Agөзј«өДөзј«·ҙУҰКҪКЗ___________Ј¬ёГөзј«өДөзј«ІъОп№І____________gЎЈ
ЈЁ3Ј©Cuөзј«өДөзј«·ҙУҰКҪКЗ____________Ј¬CuSO4ИЬТәөДЕЁ¶И____________(МоЎ°јхРЎЎұЎўЎ°ФцҙуЎұ»тЎ°І»ұдЎұ)
ЈЁ4Ј©ИзНјұнКҫөзҪвҪшРР№эіМЦРДіёцБҝ(ЧЭЧшұкx)ЛжКұјдөДұд»ҜЗъПЯЈ¬ФтxұнКҫ___________ЎЈ

aЈ®ёчUРО№ЬЦРІъЙъөДЖшМеөДМе»э
bЈ®ёчUРО№ЬЦРСфј«ЦКБҝөДјхЙЩБҝ
cЈ®ёчUРО№ЬЦРТхј«ЦКБҝөДФцјУБҝ
Ійҝҙҙр°ёәНҪвОц>>
ҝЖДҝЈәёЯЦР»ҜС§ АҙФҙЈә МвРНЈә
ЎҫМвДҝЎҝ[»ҜС§-СЎРЮ3:ОпЦКҪб№№УлРФЦК]МъЗи»ҜјШЈ¬»ҜС§КҪОӘK3[Fe(CN)6]Ј¬ЦчТӘУҰУГУЪЦЖТ©Ўўөз¶ЖЎўФмЦҪЎўёЦМъЙъІъөИ№ӨТөЎЈЖдмСЙХ·ЦҪвЙъіЙKCNЎўFeC2ЎўN2Ўў(CN)2өИОпЦКЎЈ
ЈЁ1Ј©»щМ¬KФӯЧУәЛНвөзЧУЕЕІјјтРҙКҪОӘ___________ЎЈ K3[Fe(CN)6]ЦРЛщЙжј°өДФӘЛШөД»щМ¬ФӯЧУәЛНвОҙіЙ¶ФөзЧУКэЧо¶аөДКЗ_________Ј¬ёчФӘЛШөДөЪТ»өзАлДЬУЙҙуөҪРЎөДЛіРтОӘ_________ЎЈ
ЈЁ2Ј©(CN)2·ЦЧУЦРҙжФЪМјМјјьЈ¬Фт·ЦЧУЦРҰТјьУлҰРјьКэДҝЦ®ұИОӘ_______ЎЈKCNУлСОЛбЧчУГҝЙЙъіЙHCNЈ¬HCNөДЦРРДФӯЧУөДФУ»Ҝ№мөААаРНОӘ_________ЎЈ
ЈЁ3Ј©COДЬУлҪрКфFeРОіЙFe(CO)5Ј¬ёГ»ҜәПОпИЫөгОӘ253 KЈ¬·РөгОӘОӘ376 KЈ¬Жд№ММеКфУЪ_____ҫ§МеЎЈ
ЈЁ4Ј©ПВНјКЗҪрКфөҘЦКіЈјыөДБҪЦЦ¶С»э·ҪКҪөДҫ§°ыДЈРНЎЈ

ўЩМъІЙДЙөДКЗa¶С»э·ҪКҪ.МъФӯЧУөДЕдО»КэОӘ_____Ј¬ёГҫ§МеЦРФӯЧУЧЬМе»эХјҫ§МеМе»эөДұИЦөОӘ____(УГә¬ҰРөДЧојтҙъКэКҪұнКҫ)ЎЈ
ўЪіЈјыөДҪрКфВБІЙДЙөДКЗb¶С»э·ҪКҪЈ¬ВБФӯЧУөД°лҫ¶ОӘr pmЈ¬ФтЖдҫ§МеГЬ¶ИОӘ_____gЎӨcm-3(УГә¬УРrЎўNAөДЧојтҙъКэКҪұнКҫ)ЎЈ
Ійҝҙҙр°ёәНҪвОц>>
ҝЖДҝЈәёЯЦР»ҜС§ АҙФҙЈә МвРНЈә
ЎҫМвДҝЎҝБтхЈВИ(SO2Cl2)іЈЧчВИ»ҜјБ»тВИ»З»ҜјБЈ¬УГУЪЦЖЧчТ©Ж·ЎўИҫБПЎўұнГж»оРФјБөИЎЈУР№ШОпЦКөДІҝ·ЦРФЦКИзПВұнЈә

КөСйКТУГёЙФп¶шҙҝӣ·өД¶юСх»ҜБтәНВИЖшәПіЙБтхЈВИЈ¬·ҙУҰөДИИ»ҜС§·ҪіМКҪОӘЈәSO2(g)+Cl2(g)![]() SO2Cl2(l) ЎчH=Јӯ97.3 kJЎӨ molЈӯ1
SO2Cl2(l) ЎчH=Јӯ97.3 kJЎӨ molЈӯ1
·ҙУҰЧ°ЦГИзНјЛщКҫ(јРіЦТЗЖчТСКЎВФ)Ј¬Зл»ШҙрУР№ШОКМвЈә

ЈЁ1Ј©ТЗЖчBөДГыіЖОӘ________Ј»
ЈЁ2Ј©ТЗЖчAөДЧчУГКЗ_______Ј»
ЈЁ3Ј©Ч°ЦГТТЦРКў·ЕөДКФјБОӘ______Ј¬ФЪКөСйКТУГЗвСх»ҜДЖИЬТәОьКХ¶аУаБтхЈВИөДАлЧУ·ҙУҰ·ҪіМКҪОӘ______Ј»
ЈЁ4Ј©ОӘМбёЯұҫКөСйЦРБтхЈВИөДІъВКЈ¬ФЪКөСйІЩЧчЦРРиТӘЧўТвөДКВПоУР_______(МоРтәЕ)Ј»
ўЩПИНЁАдДэЛ®Ј¬ФЩНЁЖшМе ўЪҝШЦЖЖшБчЛЩВКЈ¬ТЛВэІ»ТЛҝм
ўЫИфИэҫұЙХЖҝ·ўММЈ¬ҝЙККөұҪөОВ ўЬјУИИИэҫұЙХЖҝ
ЈЁ5Ј©ЙЩБҝБтхЈВИТІҝЙУГВИ»ЗЛб(ClSO3H)·ЦҪв»сөГЈ¬ёГ·ҙУҰөД»ҜС§·ҪіМКҪОӘЈә2ClSO3H=H2SO4+SO2Cl2Ј¬ҙЛ·Ҫ·ЁөГөҪөДІъЖ·ЦР»б»мУРБтЛбЎЈ
ўЩ·ЦҪвІъОпЦР·ЦАліцБтхЈВИөДКөСйІЩЧчГыіЖОӘ____ЎЈ
ўЪДіН¬С§ОӘјмСйБтхЈВИІъЖ·ЦРКЗ·с»мУРБтЛбЙијЖКөСйИзПВЈәИЎЙЩБҝІъЖ·ИЬУЪЛ®Ј¬јУИлСОЛбЛб»ҜөДВИ»ҜұөИЬТәЈ¬ХсөҙЈ¬№ЫІмөҪУР°ЧЙ«іБөнЙъіЙЈ¬ФтИПОӘІъЖ·ЦРә¬УРБтЛбЎЈёГН¬С§өДҪбВЫКЗ·сХэИ·Ј¬ЗлЛөГчАнУЙ____ЎЈ
Ійҝҙҙр°ёәНҪвОц>>
№ъјКѧУУЕСЎ - Б·П°ІбБРұн - КФМвБРұн
әюұұКЎ»ҘБӘНшОҘ·ЁәНІ»БјРЕПўҫЩұЁЖҪМЁ | НшЙПУРәҰРЕПўҫЩұЁЧЁЗш | өзРЕХ©ЖӯҫЩұЁЧЁЗш | ЙжАъК·РйОЮЦчТеУРәҰРЕПўҫЩұЁЧЁЗш | ЙжЖуЗЦИЁҫЩұЁЧЁЗш
ОҘ·ЁәНІ»БјРЕПўҫЩұЁөз»°Јә027-86699610 ҫЩұЁУКПдЈә58377363@163.com