
【题目】[化学-选修3:物质结构与性质]铁氰化钾,化学式为K3[Fe(CN)6],主要应用于制药、电镀、造纸、钢铁生产等工业。其煅烧分解生成KCN、FeC2、N2、(CN)2等物质。
(1)基态K原子核外电子排布简写式为___________。 K3[Fe(CN)6]中所涉及的元素的基态原子核外未成对电子数最多的是_________,各元素的第一电离能由大到小的顺序为_________。
(2)(CN)2分子中存在碳碳键,则分子中σ键与π键数目之比为_______。KCN与盐酸作用可生成HCN,HCN的中心原子的杂化轨道类型为_________。
(3)CO能与金属Fe形成Fe(CO)5,该化合物熔点为253 K,沸点为为376 K,其固体属于_____晶体。
(4)下图是金属单质常见的两种堆积方式的晶胞模型。

①铁采纳的是a堆积方式.铁原子的配位数为_____,该晶体中原子总体积占晶体体积的比值为____(用含π的最简代数式表示)。
②常见的金属铝采纳的是b堆积方式,铝原子的半径为r pm,则其晶体密度为_____g·cm-3(用含有r、NA的最简代数式表示)。
【答案】 [Ar]4s1 Fe(铁) N>C>Fe>K 3:4 sp 分子 8 ![]()
![]()
【解析】(1)钾(K)为19号元素,原子核外共有19个电子,由于3p和4s轨道能级交错,第19个电子填入4s轨道而不填入3p轨道,基态K原子核外电子排布式为1s22s22p63s23p64s1简写为:[Ar]4s1;Fe原子的基态电子排布式为:1s22s22p63s23p63d64s2,C原子的基态电子排布式为:1s22s22p2,N原子的基态电子排布式为:1s22s22p3,则K、Fe、C、N基态原子核外未成对电子数依次为:1、4、2、3,所以K3[Fe(CN)6]中所涉及的元素的基态原子核外未成对电子数最多的是Fe(铁)。第一电离能是原子失去最外层的一个电子所需能量,第一电离能主要体现的是元素失电子的能力,C、N为非金属元素都较难失电子,C、N同周期,N原子序数大于C,且N最外层2p能级容纳3的电子,为半满稳定状态,能量较低,第一电离能也高于同周期相邻元素;K、Fe是金属元素都较易失电子,且K比Fe活泼,故K的第一电离能小于Fe的第一电离能,综上分析,各元素的第一电离能由大到小的顺序为:N>C>Fe>K。
(2)(CN)2分子中存在碳碳键,结构式为N![]() C-C
C-C![]() N,共价单键是σ键,共价三键中含有2个π键1个σ键,则分子中σ键与π键数目之比为3:4。HCN的结构式为H-C
N,共价单键是σ键,共价三键中含有2个π键1个σ键,则分子中σ键与π键数目之比为3:4。HCN的结构式为H-C![]() N,所以碳为中心原子,形成4个共价键,没有孤电子对,碳的价层电子对为2,sp杂化。
N,所以碳为中心原子,形成4个共价键,没有孤电子对,碳的价层电子对为2,sp杂化。
(3)Fe(CO)5的熔点为253K,沸点为376K,熔沸点比较低,属于分子晶体。
(4)①铁的a堆积方式为体心立方堆积,与一个铁原子最近的铁原子距离为立方体边长的![]() ,这样的原子有八个,所以铁的配位数为8;如图所示:
,这样的原子有八个,所以铁的配位数为8;如图所示:
 ,晶胞中铁原子数为:8×
,晶胞中铁原子数为:8×![]() +1×=2,体心立方晶胞中r=
+1×=2,体心立方晶胞中r= ![]() ,所以铁原子总体积=2×
,所以铁原子总体积=2×![]() =2×
=2×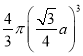 =
=![]() ,晶胞体积=a3,则该晶体中原子总体积占晶体体积的比值为
,晶胞体积=a3,则该晶体中原子总体积占晶体体积的比值为![]() 。
。
②②铝的b堆积方式为面心立方堆积,晶胞中含有Al原子数为:8×![]() +6×
+6×![]() =4,则晶胞质量为:
=4,则晶胞质量为: ![]() g;该晶胞结构侧面可用如图表示:
g;该晶胞结构侧面可用如图表示: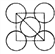 ,铝原子半径rpm=r×10-10cm,设晶胞边长为acm,晶胞边长a与铝原子的半径为r的关系为:2a2=(4r×10-10)2,解得a=
,铝原子半径rpm=r×10-10cm,设晶胞边长为acm,晶胞边长a与铝原子的半径为r的关系为:2a2=(4r×10-10)2,解得a=![]() r×10-10,所以晶胞体积为:(
r×10-10,所以晶胞体积为:(![]() r×10-10)3cm3,根据密度=质量÷体积,则晶体密度为:
r×10-10)3cm3,根据密度=质量÷体积,则晶体密度为: ![]() g÷(
g÷(![]() r×10-10)3cm3=
r×10-10)3cm3=![]() g·cm-3。
g·cm-3。


科目:高中化学 来源: 题型:
【题目】有主族元素A,B,C,D四种元素,原子序数依次递增,A元素原子2p轨道上有2个未成对电子。B原子的p轨道中有3个未成对电子,其气态氢化物在水中的溶解度在同族元素所形成的氢化物中最大。C的最高化合价和最低化合价的代数和为4,其最高价氧化物中含C的质量分数为40%,且其核内质子数等于中子数。D原子得一个电子填入3p轨道后,3p轨道为全充满。
请回答下列问题:
(1)AC2分子中含有______个π键,属于________分子(填“极性”或“非极性”)。
(2)B的氢化物的立体构型为____________,B原子的原子轨道采用________杂化。
(3)写出A的常见氧化物与B的氧化物中互为等电子体的一组物质:_______________________________。
(4)C元素的电负性________D元素的电负性(填“>”、“<”或“=”);用一个化学方程式表示:_________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】雾霾严重危害人类健康和生态环境,开发稳定高效的脱硫脱硝工艺技术是国内外研究的热点。研究表明,氮氧化物(NOx)和二氧化硫在形成雾霾时与大气中的氨有关,其转化关系如下图所示。

(1)NH3的电子式是_________。
(2)NH4NO3溶液中的离子浓度由大到小顺序是_________。
(3)①已知:SO2生成SO3总反应方程式是
2SO2(g)+O2(g) ![]() 2SO3(g) ΔH=-196.6 kJ/mol
2SO3(g) ΔH=-196.6 kJ/mol
此反应可通过如下两步完成:
2NO(g)+O2 (g ) ![]() 2NO2(g) ΔH1=-113 kJ/mol
2NO2(g) ΔH1=-113 kJ/mol
NO2(g)+SO2(g) ![]() SO3(g)+NO(g) ΔH2=_________。
SO3(g)+NO(g) ΔH2=_________。
② 一定温度下,向2 L恒容密闭容器中充入NO2和SO2各1 mol,5min达到平衡,此时容器中NO2和NO的浓度之比为1∶3,则NO2的平衡转化率是_________。
(4)利用NaClO2/H2O2酸性复合吸收剂可同时有效脱硫、脱硝。
① 制备少量NaClO2,其装置如下图所示:

装置I控制温度在35~55℃,通入SO2将NaClO3还原为ClO2(沸点:11℃),反应的离子方程式是_____________________________________________,
装置Ⅱ中反应生成NaClO2,此反应中作为氧化剂的是_______________,反应后溶液中阴离子除了ClO2-、ClO3-、Cl-、ClO-、OH-外还可能含有的一种阴离子是_______________。
② 用制得的NaClO2/H2O2酸性复合吸收剂同时对NO、SO2进行氧化得到硝酸和硫酸而除去。在温度一定时,n(H2O2)/n(NaClO2)、溶液pH对脱硫脱硝的影响如下图所示:


从上图中可知脱硫脱硝最佳条件是_________。图 中SO2的去除率随pH的增大而增大,而NO 的去除率在pH>5.5时反而减小,请解释NO去除率减小的可能原因是______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】18世纪70年代,瑞典化学家舍勒将软锰矿与浓盐酸混合加热,发现了氯气的方法至今还是实验室制备氯气的主要方法,下列关于实验室制氯气的说法中正确的是( )
A.浓盐酸在反应中起到酸性和氧化剂作用
B.将87g MnO2和足量浓盐酸反应,与将含有146gHCl的浓盐酸与足量MnO2反应制得的氯气一样多
C.为防止氯气污染环境,必须进行尾气处理,可选用饱和石灰水
D.收集氯气时,可采用湿润的淀粉KI试纸进行验满
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定条件下,可逆反应N2+3H2![]() 2NH3(正反应是放热反应)达到平衡,当单独改变下列条件后,有关叙述错误的是( )
2NH3(正反应是放热反应)达到平衡,当单独改变下列条件后,有关叙述错误的是( )
A. 加催化剂,v正、v逆都发生变化,且变化的倍数相等
B. 加压,v正、v逆都增大,且v正增大的倍数大于v逆增大的倍数
C. 降温,v正、v逆减小,且v正减小的倍数大于v逆减小的倍数
D. 体积不变,加入氩气,v正、v逆都保持不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在容积为2 L的恒容密闭容器中,加入1 mol A(g)、2 mol B(g)发生如下反应:A(g)+2B(g)![]() C(g)+D(g)。在不同温度下,D的物质的量n(D)和时间t的关系如下图所示。
C(g)+D(g)。在不同温度下,D的物质的量n(D)和时间t的关系如下图所示。

试回答下列问题:
(1)温度为T1℃时,0~5 min内,以B表示的平均反应速率为________。
(2)T1℃________(填“<”或“>”)T2℃,该反应的正反应是________(填“放热”或“吸热”)反应。
(3)T1℃时,向上述平衡体系中再充入1 mol A、2 mol B,达到平衡时,D的物质的量n(D)________(填“>”、“<”或“=”)1.2 mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碳九芳烃是一种混合物,异丙苯就是其中的一种。工业上可用异丙苯氧化法生产苯酚和丙酮,其反应和工艺流程示意图如下。下列有关说法正确的是
![]()
A. a的同分异构体有7种B. a能发生取代反应、加成反应和氧化反应
C. b的分子式为![]() D. b、c互为同系物
D. b、c互为同系物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究小组拟合成染料X和医药中间体Y。

已知:

回答下列问题:
(1)A的系统命名为________________。
(2)C的结构简式为 ____________。
(3)B到C的反应类型是________________。
(4)C+D→E的化学反应方程式为________ 。
(5)F的分子式为____________。
(6)G与A互为同分异构体,请写出满足下列条件的任意两种G的结构简式______________。
①核磁共振氢谱显示G分子中有4个吸收峰;
②红外光谱显示G分子中含有苯环、甲氧基(![]() ),没有羟基、过氧键(-O-O-)
),没有羟基、过氧键(-O-O-)
(7)设计以![]() 和
和![]() 为原料制备Y(
为原料制备Y( )的合成路线(用流程图表示,无机试剂任选)_______________________________________________________。
)的合成路线(用流程图表示,无机试剂任选)_______________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了制取纯净干燥的气体A,可用如图所示装置,生成A的速度可通过滴入液体B的速度控制,已知A是一种无色、无味、不能使酸碱指示剂变色、也不会在空气中燃烧的气体,但能使带火星的木条复燃。

(1)A是________。
(2)若C是一种淡黄色固体,则烧瓶中发生反应的化学方程式是_______________________。
(3)若C是一种黑色粉末,则B物质是________,C物质的作用是__________________。
(4)洗气瓶(广口瓶)中装的试剂D是________,其作用是_______。所制得的气体用________法收集。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com