
【题目】Ⅰ、回答下列问题:
(1)0.005mol/L 的H2SO4溶液的pH为_______。
(2)常温时,0.1mol/L的NaOH和0.06mol/L 的HCl溶液等体积混合,求混合溶液的pH为_______。
(3)某温度时,测得0.01 mol·L-1的NaOH溶液的pH为11,则该温度下水的离子积常数KW=___,该温度___ (填“高于”或“低于”)25 ℃。
(4)常温下,pH=13的Ba(OH)2溶液a L与pH=3的H2SO4溶液b L混合(混合后溶液体积变化忽略不计)。若所得混合溶液呈中性,则a∶b=________。
(5)氯化铁水溶液呈酸性,原因是(用离子方程式表示):___________。实验室在临时配制一些氯化铁溶液时,常将氯化铁固体先溶于较浓的_______中,然后再用蒸馏水稀释到所需的浓度,是为了抑制其水解。
【答案】2 12.3 10-13 高于 1:100 Fe3++H2O![]() Fe(OH)3+3H+ 盐酸
Fe(OH)3+3H+ 盐酸
【解析】
Ⅰ、⑴0.005mol/L 的H2SO4溶液,c(H+) = 0.005mol/L×2 = 0.01mol/L,pH=-lg c(H+) = -lg0.01=2,故答案为2;
⑵常温时,0.1mol/L的NaOH和0.06mol/L 的HCl溶液等体积混合,分析得出NaOH过量,溶液最终显碱性,因此![]()
![]() ,pH=-lg c(H+) = -lg5×10-13 = 13-lg5 = 12.3,故答案为12.3;
,pH=-lg c(H+) = -lg5×10-13 = 13-lg5 = 12.3,故答案为12.3;
⑶某温度时,测得0.01 mol·L-1的NaOH溶液的pH为11,c(OH-)=0.01 mol·L-1,c(H+) =1×10-11,KW=c(H+)c(OH-) =1×10-11× 0.01 = 1×10-13,由于1×10-13 > 1×10-14(25C),该温度高于25 ℃,故答案为1×10-13;高于;
⑷常温下,pH=13的Ba(OH)2溶液a L与pH=3的H2SO4溶液b L混合(混合后溶液体积变化忽略不计)。pH=13的Ba(OH)2,溶液中氢氧根浓度为c(OH-) = 1×10-1 mol·L-1,pH=3的H2SO4溶液c(H+) =1×10-3 mol·L-1,若所得混合溶液呈中性,则n(H+) = n(OH-),即c(H+)V(酸) = c(OH-) V(碱) ,1×10-3×b = 1×10-1×a,a∶b=1:100,故答案为1:100;
⑸氯化铁水溶液呈酸性,主要是铁离子水解显酸性,用离子方程式表示为:Fe3++H2O![]() Fe(OH)3+3H+,实验室在临时配制一些氯化铁溶液时,常将氯化铁固体先溶于较浓的盐酸中,主要目的是抑制水解,然后再用蒸馏水稀释到所需的浓度,故答案为Fe3++H2O
Fe(OH)3+3H+,实验室在临时配制一些氯化铁溶液时,常将氯化铁固体先溶于较浓的盐酸中,主要目的是抑制水解,然后再用蒸馏水稀释到所需的浓度,故答案为Fe3++H2O![]() Fe(OH)3+3H+;盐酸。
Fe(OH)3+3H+;盐酸。


科目:高中化学 来源: 题型:
【题目】反应![]() 在一个密闭容器中进行,下列措施可以使反应速率增大的是( )
在一个密闭容器中进行,下列措施可以使反应速率增大的是( )
①增加少量![]() ②升高温度③体积不变,再通入
②升高温度③体积不变,再通入![]() ④缩小体积增大压强⑤体积不变,再通入He⑥压强不变,再通入He
④缩小体积增大压强⑤体积不变,再通入He⑥压强不变,再通入He
A. ![]() B.
B. ![]() C.
C. ![]() D.
D. ![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学通过以下装置测定M样品(只含Fe、Al、Cu)中各成分的质量分数。取两份质量均为m g的M样品,按实验1(如图1)和实验2(如图2)进行实验,该同学顺利完成了实验并测得气体体积分别为V1 mL和V2 mL(已折算到标准状况下)。
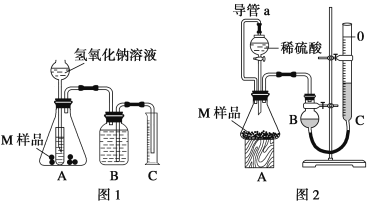
(1)写出实验1中可能发生反应的离子方程式:____________。
(2)该实验需要0.50 mol·L-1的NaOH溶液480 mL,请回答下列问题:
①配制时应用托盘天平称量______g NaOH,应选择________ ml容量瓶。
②配制NaOH溶液时,NaOH固体中含有Na2O杂质会导致所配溶液浓度________。(填“偏大”、“偏小”或“无影响”)。
(3)该实验中所用稀硫酸是用98%的浓硫酸(ρ=1.84g/cm3)配制的,则该浓硫酸的物质的量浓度是_______。
(4)对于实验2,读数时冷却至室温除视线平视外,还应进行的操作是: ___________。
(5)实验2中导管a的作用_________。
(6)M样品中铜的质量的数学表达式为(用V1和V2 表示):_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】苯酚(结构简式如图所示),俗称石炭酸。是一种重要的化工原料,广泛用于制适酚醛树脂、染料、医药、农药等。下列说法不正确的是( )
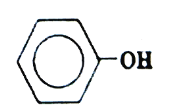
A.分子中所有原子可能共平面
B.固体苯酚分子间可能形成氢键
C.![]() 该分子充分燃烧,会消耗
该分子充分燃烧,会消耗![]()
D.![]() 该分子与足量的氢气加成后,环上的一氯取代物有3种
该分子与足量的氢气加成后,环上的一氯取代物有3种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z和W代表原子序数依次增大的四种短周期元素,它们满足以下条件:
①元素周期表中,Z与Y相邻,Z与W也相邻;②Y、Z和W三种元素的原子最外层电子数之和为17。
请填空:
(1)Y、Z和W是否位于同一周期(填“是”或“否”):__________,理由是________________。
(2)Y是_______,Z是_______,W是_______。
(3)X、Y、Z和W可组成一种化合物,其原子个数比为8∶2∶4∶1,写出该化合物的名称及化学式: _______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,向10mL 0.1 molL1一元弱碱XOH溶液中逐滴滴加0.1 molL1的HCl溶液,溶液的变化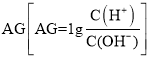 如图所示(溶液混合时体积变化忽略不计)。下列说法正确的是( )
如图所示(溶液混合时体积变化忽略不计)。下列说法正确的是( )
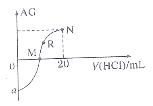
A.a的最小值是12
B.M点消耗盐酸的体积为10mL
C.R点溶液中可能存在![]()
D.M点到N点,水的电离程度逐渐增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在目前市面上防护新冠病毒的消毒剂中,二氧化氯消毒剂是相对高效更安全的产品。二氧化氯的熔点为![]() ,沸点为
,沸点为![]() ,易溶于水但不与水反应,在生产和使用时必须用空气、二氧化碳、氮气等“惰性”气体进行稀释,但温度过高、气相浓度过大时均易发生爆炸。工业上用稍潮湿的
,易溶于水但不与水反应,在生产和使用时必须用空气、二氧化碳、氮气等“惰性”气体进行稀释,但温度过高、气相浓度过大时均易发生爆炸。工业上用稍潮湿的![]() 和草酸在
和草酸在![]() 时反应制得(如下图所示),在
时反应制得(如下图所示),在![]() 装置内用冷水吸收
装置内用冷水吸收![]() 。
。
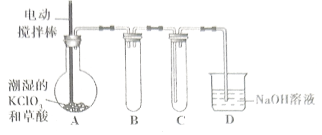
(1)装置A中发生反应:![]() (未配平),当生成
(未配平),当生成![]() 时,同时产生标准状况下
时,同时产生标准状况下![]() 的体积是______
的体积是______![]() 。
。
(2)实验时,对A装置进行加热操作还需要的玻璃仪器有酒精灯、_____、_______。
(3)本实验哪些设计从实验安全角度考虑______。(填2条)
(4)装置D中,![]() 与
与![]() 溶液反应可生成两种盐,且二者物质的量之比为
溶液反应可生成两种盐,且二者物质的量之比为![]() ,其中一种是
,其中一种是![]() 。
。
①写出![]() 与
与![]() 溶液反应的离子方程式_______。
溶液反应的离子方程式_______。
②已知饱和![]() 溶液随温度变化情况如下图:
溶液随温度变化情况如下图:
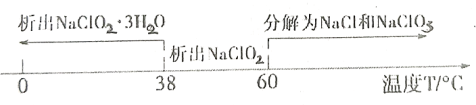
从![]() 溶液中获得
溶液中获得![]() 晶体的操作步骤为:减压蒸发结晶→______→______→
晶体的操作步骤为:减压蒸发结晶→______→______→![]() 干燥,得到成品。(选择合适的操作编号填空)
干燥,得到成品。(选择合适的操作编号填空)
A.冷却到室温后,过滤 B.趁热过滤 C.常温洗涤 D.冰水洗涤 E.![]() 的温水洗涤
的温水洗涤
采用减压蒸发的原因是_____。
(5)如果以单位质量的氧化剂所得到的电子数来表示消毒效率,那么,![]() 、
、![]() 、
、![]() 三种消毒杀菌剂的消毒效率由小到大的顺序是____(填化学式)。
三种消毒杀菌剂的消毒效率由小到大的顺序是____(填化学式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在2L的密闭容器中,发生以下反应:2A(g)+ B(g) ![]() 2C(g)+D(g) 。若最初加入的A和B都是4 mol,在前10秒钟A的平均反应速度为0.12 mol/(L·s),则10秒钟时,容器中B的物质的量是( )
2C(g)+D(g) 。若最初加入的A和B都是4 mol,在前10秒钟A的平均反应速度为0.12 mol/(L·s),则10秒钟时,容器中B的物质的量是( )
A. 1.6 mol B. 2.8 mol
C. 2.4 mol D. 1.2 mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用如下实验探究铁钉在不同溶液中的吸氧腐蚀。
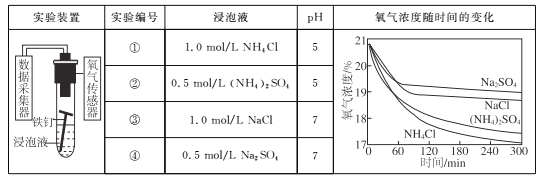
下列说法不正确的是
A. 上述正极反应均为O2+4e-+2H2O=4OH-
B. 在不同溶液中,Cl是影响吸氧腐蚀速率的主要因素
C. 向实验④中加入少量(NH4)2SO4固体,吸氧腐蚀速率加快
D. 在300 min内,铁钉的平均吸氧腐蚀速率酸性溶液大于中性溶液
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com