
【题目】高温裂解法处理工业废硫酸的原理为:2H2SO4(l)=2SO2(g)+O2(g)+2H2O(g) △H=+ 550 kJ/mol,它由两步反应组成:
i.H2SO4(l)=SO3(g)+H2O(g)△H=+177kJ/molii.SO3(g)分解。
(1)SO3(g)分解的热化学方程式为________________。
(2)工业上常用SO2制备Na2S2O3,向0.1 mol/L的Na2S2O3溶液中滴加稀硫酸的离子方程式为_________。
(3)反应ii的△S_______________0(填 “>”、 “<”、 “=”)。
(4)对反应ii,可用V2O5 作催化剂。已知:SO2+V2O5![]() SO3+V2O4 K1、1/2O2+V2O4
SO3+V2O4 K1、1/2O2+V2O4![]() V2O5 K2, 则在相同温度下,2SO3(g)
V2O5 K2, 则在相同温度下,2SO3(g)![]() 2SO2(g)+O2(g)的平衡常数 K=______________(用K1、K2表示)。
2SO2(g)+O2(g)的平衡常数 K=______________(用K1、K2表示)。
(5) L(L1、L2),X可分别代表压强或温度,右图表示L一定时,反应ii中SO3(g)的平衡转化率随X的变化关系。

①X代表的物理量是_________________;
②比较L1、L2的大小_________________。
(6)维持体系总压p恒定,在T oC时,物质的量为9 mol、体积为2L的SO3(g)发生反应:2SO3(g)![]() 2SO2(g)+O2(g), 已知SO3的平衡转化率25%,则在该温度下反应的平衡常数K=_____________(用最简分数表示)。
2SO2(g)+O2(g), 已知SO3的平衡转化率25%,则在该温度下反应的平衡常数K=_____________(用最简分数表示)。
【答案】
(1)2SO3(g)=2SO2(g)+O2(g)△H=+196kJ/mol;
(2)S2O32-+2H+=S↓+SO2↑+H2O;
(3)>;(4)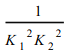 ;
;
(5)①压强②L2>L1(6)1/18mol/L
【解析】
试题分析:(1)由题意知,
①2H2SO4(l)═2SO2(g)+O2(g)+2H2O(g)△H=+550kJmol-1
②H2SO4(l)═SO3(g)+H2O(g)△H=+177kJmol-1
将方程式①-2②得2SO3(g)![]() 2SO2(g)+O2(g)
2SO2(g)+O2(g)
△H=(+550kJmol-1)-2(+177kJmol-1)=+196kJmol-1,
故答案为:2SO3(g)2SO2(g)+O2(g)△H=+196kJmol-1;
(2)Na2S2O3溶液中滴加稀硫酸发生氧化还原反应生成二氧化硫和单质硫,该反应的的离子方程式为:S2O32-+ 2H+ = S↓ +SO2↑ + H2O。
(3)2SO3(g)2SO2(g)+O2(g)是气体分子数最多的反应,所以△S>0。
(4)已知:①SO2+V2O5 ![]() SO3+V2O4 K1、②1/2O2+V2O4
SO3+V2O4 K1、②1/2O2+V2O4![]() V2O5 K2,-2×(①+②)可得反应2SO3(g)
V2O5 K2,-2×(①+②)可得反应2SO3(g) ![]() 2SO2(g)+O2(g),则在相同温度下,2SO3(g)
2SO2(g)+O2(g),则在相同温度下,2SO3(g)![]() 2SO2(g)+O2(g)的平衡常数为
2SO2(g)+O2(g)的平衡常数为![]() ;
;
(5)①由图可知,X越大,转化率越低,升高温度转化率增大,则X表示压强;
②由2SO3(g)2SO2(g)+O2(g) △H>0,温度高,转化率大,图中等压强时L2对应的转化率大,则L1<L2。
(6)维持体系总压p恒定,在T oC时,物质的量为9 mol、体积为2L的SO3(g)发生反应:2SO3(g)![]() 2SO2(g)+O2(g), 当SO3的平衡转化率25%时,参加反应的SO3的物质的量为9/4mol,生成SO29/4mol,生成O29/8mol,达到平衡时气体物质的量总和为(9-9/4)mol+9/4mol+9/8mol=81/8mol。由于总压强恒定,所以,达到平衡后气体体积为9/4L,则平衡时各物质的浓度为c(SO3)=3mol/L、c(SO2)=1mol/L、c(O2)=0.5mol/L,则在该温度下反应的平衡常数K=[c2(SO2)c(O2)]/c2(SO3)=1/18mol/L。
2SO2(g)+O2(g), 当SO3的平衡转化率25%时,参加反应的SO3的物质的量为9/4mol,生成SO29/4mol,生成O29/8mol,达到平衡时气体物质的量总和为(9-9/4)mol+9/4mol+9/8mol=81/8mol。由于总压强恒定,所以,达到平衡后气体体积为9/4L,则平衡时各物质的浓度为c(SO3)=3mol/L、c(SO2)=1mol/L、c(O2)=0.5mol/L,则在该温度下反应的平衡常数K=[c2(SO2)c(O2)]/c2(SO3)=1/18mol/L。
故答案为:1/18mol/L。


科目:高中化学 来源: 题型:
【题目】直接排放含SO2的烟气会形成酸雨,危害环境。利用钠碱循环法直接排放含SO2的烟气会形成酸雨,危害环境.利用钠碱循环法可脱除烟气中的SO2,在钠碱循环法中,Na2SO3溶液作为吸收液,可由NaOH溶液吸收SO2制得,
(1)吸收液吸收SO2的过程中,pH随n(SO32-):n(HSO3-)变化关系如下表:
n(SO32-):n(HSO3-) | 91:9 | 1:1 | 1:91 |
pH | 8.2 | 7.2 | 6.2 |
①上表判断NaHSO3溶液显________性,用化学平衡原理解释:__________________。
②当吸收液呈中性时,溶液中离子浓度关系正确的是(选填字母):____________。
A.c(Na+)=2c(SO32-)+c(HSO3-)
B.c(Na+)>c(HSO3-)>c(SO32-)>c(H-)=c(OH-)
C.c(Na+)+c(H-)=c(SO32-)+c(HSO3-)+c(OH-)
(2) 能证明Na2SO3溶液中存在SO32-+H2O![]() HSO3-+OH-水解平衡的事实是________(填序号)。
HSO3-+OH-水解平衡的事实是________(填序号)。
A.滴入酚酞溶液变红,再加入H2SO4溶液后红色褪去
B.滴入酚酞溶液变红,再加入氯水后红色褪去
C.滴入酚酞溶液变红,再加入BaCl2溶液后产生沉淀且红色褪去
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】从古至今,铁及其化合物在人类生产生活中的作用发生了巨大变化。
(1)古代中国四大发明之一的司南是由天然磁石制成的,其主要成分是______(填字母序号)。
a. Fe b. FeO c. Fe3O4 d. Fe2O3
(2) 现代利用铁的氧化物循环裂解水制氢气的过程如下图所示。 整个过程与温度密切相关, 当温度低于 570℃时,反应Fe3O4(s)+4 CO(g)![]() 3Fe(s)+4 CO2(g),阻碍循环反应的进行。
3Fe(s)+4 CO2(g),阻碍循环反应的进行。
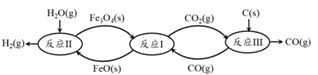
① 已知:Fe3O4(s) + CO(g) ![]() 3FeO(s) +CO2(g) ΔH1 = +19.3 kJ·mol-1
3FeO(s) +CO2(g) ΔH1 = +19.3 kJ·mol-1
3FeO(s) + H2O(g)![]() Fe3O4(s) + H2(g) ΔH2 =-57.2 kJ·mol-1
Fe3O4(s) + H2(g) ΔH2 =-57.2 kJ·mol-1
C(s)+CO2![]() 2CO(g) ΔH3 =+172.4 kJ·mol-1 。
2CO(g) ΔH3 =+172.4 kJ·mol-1 。
铁氧化物循环裂解水制氢气总反应的热化学方程式是_________。
② 下图表示其他条件一定时, Fe3O4(s)和 CO(g)反应达平衡时 CO(g)的体积百分含量随温度的变化关系。
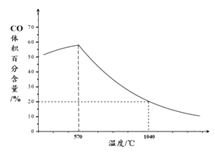
i. 当温度低于570℃时,温度降低CO的转化率____(填“增大”、“减小”或“不变”),理由是______。
ii. 当温度高于570℃时,随温度升高,反应 Fe3O4(s) + CO(g) ![]() 3FeO(s) + CO2(g)平衡常数的变化趋势是________;(填“增大”、“减小”或“不变”)1040℃时,该反应的化学平衡常数的数值是________。
3FeO(s) + CO2(g)平衡常数的变化趋势是________;(填“增大”、“减小”或“不变”)1040℃时,该反应的化学平衡常数的数值是________。
(3)① 古老而神奇的蓝色染料普鲁士蓝的合成方法如下:

复分解反应 ii 的离子方程式是_______________。
② 如今基于普鲁士蓝合成原理可检测食品中 CN-,方案如下:
![]()
若试纸变蓝则证明食品中含有 CN-,请解释检测时试纸变蓝的原因_________。
(4)已知25℃时,Kap[Fe(OH)3]=4.0×10-38,此温度下若在实验室中配置100mL 5mol/LFeCl3溶液,为使配置过程中不出现浑浊现象,则至少需要加入2mol/L的盐酸_________mL(忽略加入盐酸体积)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组中的离子,能在溶液中大量共存的是( )
A.K+、H+、SO42-、OH- B.Na+、Ca2+、CO32-、NO3-
C.Na+、H+、Cl-、CO32- D.Na+、Cu2+、Cl-、SO42-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酸亚铁铵[(NH4)2Fe(SO4)2]常用作化学试剂,也用于冶金、电镀等
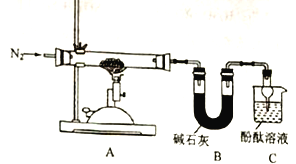
回答下列问题:
(1)甲组同学按照如图所示的装置,通过实验检验硫酸亚铁铵强热时的分解产物。
装置B的主要作用是______________________________。
装置C中可观察到的现象是______________________________。
(2)乙组同学选用甲组实验中的装置A和下图所示的装置,进行实验验证:硫酸亚铁铵晶体分解的产物中还含有SO3(g)、SO2(g)。
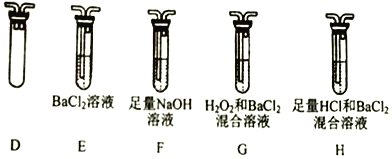
①乙组同学的实验装罝中,依次连接的合理顺序为A→______→______→______→______。
②要证明分解产物中有SO2,开始加热前应____________________,证明产物中有SO2的实验现象为_________________________;能证明分解产物中有SO3的实验现象是____________________。
(3)设计实验证明A中硫酸亚铁铵完全分解后的固体产物中只含Fe2O3:_____________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列溶液中离子浓度关系的表示正确的是( )
A.NaHCO3溶液中:c(H+)+c(Na+)=c(OH-)+c(CO![]() )+c(HCO
)+c(HCO![]() )
)
B.pH=3的CH3COOH溶液与pH=11的NaOH溶液等体积混合后的溶液中:c(OH-)>c(H+)+c(CH3COO-)
C.0.1 mol·L-1的NH4Cl溶液中:c(Cl-)>c(H+)>c(NH![]() )>c(OH-)
)>c(OH-)
D.物质的量浓度相等的CH3COOH和CH3COONa溶液等体积混合后的溶液中:
2c(Na+)=c(CH3COOH)+c(CH3COO-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知温度T时水的离子积常数为KW。该温度下,将浓度为a mol/L的一元酸HA与b mol/L的一元碱BOH等体积混合,可判定混合溶液呈中性的依据是
A.a = b B.pH = 7
C.c(H+) = ![]() mol/L D.c(H+) + c(B-) = c(OH-) + c(A-)
mol/L D.c(H+) + c(B-) = c(OH-) + c(A-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锂铜空气燃料电池容量高、成本低,具有广阔的发展前景。该电池工作时发生复杂的铜腐蚀现象,电池总反应为:2Li+Cu2O+H2O=2Cu+2Li++2OH,其工作原理如图所示,下列说法不正确的是
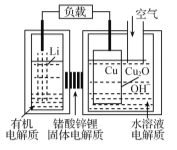
A.电池放电时,正极附近溶液pH增大
B.工作时,Li+透过固体电解质向Cu极移动
C.电池放电过程中,空气中的O2并不参加反应
D.两极的有机电解质和水溶液电解质不可对换
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com