
【题目】工业上以铬铁矿(主要成分为FeOCr2O3)、碳酸钠、氧气、和硫酸为原料生产重铬酸钠(Na2Cr2O72H2O),其主要反应为:
(1)4FeOCr2O3+8Na2CO3+7O2![]() 8Na2CrO4+2Fe2O3+8CO2
8Na2CrO4+2Fe2O3+8CO2
(2)2Na2CrO4+H2SO4![]() Na2SO4+Na2Cr2O7+H2O
Na2SO4+Na2Cr2O7+H2O
下列说法正确的是( )
A. 反应(1)和(2)均为氧化还原反应
B. 反应(1)的氧化剂是O2,还原剂是FeOCr2O3
C. 高温下,O2的氧化性强于Fe2O3,弱于Na2CrO4
D. 反应(1)中每生成1molNa2CrO4时电子转移3mol
科目:高中化学 来源: 题型:
【题目】高铁酸钠(Na2FeO4)是具有紫色光泽的粉末,是一种高效绿色强氧化剂,碱性条件下稳定,可用于废水和生活用水的处理。实验室以石墨和铁钉为电极,以不同浓度的NaOH溶液为电解质溶液,控制一定电压电解制备高铁酸钠,电解装置和现象如下:
c(NaOH) | 阴极现象 | 阳极现象 |
1 mol·L-1 | 产生无色气体 | 产生无色气体,10min内溶液颜色无明显变化 |
10 mol·L-1 | 产生大量无色气体 | 产生大量无色气体,3min后溶液变为浅紫红色,随后逐渐加深 |
15 mol·L-1 | 产生大量无色气体 | 产生大量无色气体,1min后溶液变为浅紫红色,随后逐渐加深 |
下列说法不正确的是

A. a为铁钉,b为石墨
B. 阴极主要发生反应:2H2O + 2e-=== H2↑+ 2OH-
C. 高浓度的NaOH溶液,有利于发生Fe-6e-+ 8OH-=== FeO42-+ 4H2O
D. 制备Na2FeO4时,若用饱和NaCl溶液,可有效避免阳极产生气体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海水是巨大的资源宝库。下图是人类从海水资源获取某些重要化工原料的流程示意图。

回答下列问题:
(1)操作B是______________(填实验基本操作名称)。
(2)操作B需加入下列试剂中的一种,最合适的是_________。
a.氢氧化钠溶液 b.澄清石灰水 c.石灰乳 d.碳酸钠溶液
(3)工业上制取金属镁时是电解熔MgCl2,电解反应方程式为_________________。
(4)上图中虚线框内流程的主要作用是____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由NO2、O2、熔融盐NaNO3组成的燃料电池如图所示,在使用过程中石墨I电极反应生成一种氧化物Y,下列有关说法正确的是
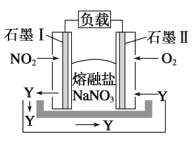
A. 石墨I极为正极,石墨II极为负极
B. Y的化学式可能为NO
C. 石墨I极的电极反应式为NO2+NO3--e-=N2O5
D. 石墨II极上发生氧化反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在下列溶液中能大量共存的无色透明离子组是( )
A.K+、Na+、NO3﹣、MnO4﹣
B.K+、Na+、Cl﹣、SO42﹣
C.K+、Na+、Br﹣、Cu2+
D.Na+、Ba2+、OH﹣、SO42﹣
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列说法正确的是
A. 28g乙烯与环丁烷的混合气体中含有6NA个原子
B. 足量MnO2和含有2molHCl的浓盐酸共热,完全反应可生成0.5NA个Cl2分子
C. 标准状况下,22.4LNO2溶于水转移NA个电子
D. 6g金刚石中含有2NA个碳碳单健
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲烷在日常生活及有机合成中用途广泛。某研究小组研究甲烷在高温下气相裂解反应的原理及其应用。
(1)已知CH4(g)+2O2(g)=CO2(g)+2H2O △H=- Q1kJ·mol-1
C2H2(g)+O2(g)=2CO2(g)+H2O(l) △H=- Q2kJ·mol-1
H2(g)+ ![]() O2=(g)=H2O(l) △H=- Q3kJ·mol-1
O2=(g)=H2O(l) △H=- Q3kJ·mol-1
则甲烷气相裂解反应:2CH4(g)=C2H2(g)+3H2(g)的△H=____________kJ·mol-1
(2)该研究小组在研究过程中得出当甲烷分解时,几种气体平衡时分压(Pa)与温度(℃)的关系如图所示。
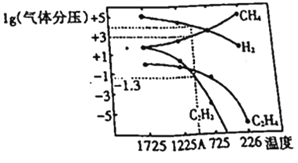
①T1℃时,向2L恒容密闭容器中充入0.3molCH4,发生反应2CH4(g) ![]() C2H6(g)+2H2 (g),达到平衡时,测得c(C2H4)=c(CH4)。该反应达到平衡时,CH4的转化率为_________________。
C2H6(g)+2H2 (g),达到平衡时,测得c(C2H4)=c(CH4)。该反应达到平衡时,CH4的转化率为_________________。
②对上述平衡状态,若改变温度至T2℃,经10s后再次达到平衡,c(CH4)=2c(C2H4),则10s内C2H4平均反应速率r(C2H4) =__________,上述变化过程中T1______T2(填“>”或“<”),判断理由是_________________。
③对于容器中发生的2CH4(g)![]() C2H2(g)+3H2(g),列式计算该反应在图中A点温度时的平衡常数K_____(用平衡分压代替平衡浓度);(已知1g0.05=-1.3)。若只改变一个反应条件使该反应的平衡常数的K值变大。则该条件是:_________(填序号)
C2H2(g)+3H2(g),列式计算该反应在图中A点温度时的平衡常数K_____(用平衡分压代替平衡浓度);(已知1g0.05=-1.3)。若只改变一个反应条件使该反应的平衡常数的K值变大。则该条件是:_________(填序号)
A.可能减小了C2H2的浓度 B.一定是升高了温度
C.可能增大了反应体系的压强 D.可能使用了催化剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)下列各组中:
①金刚石 ②12C ③液氯 ④ 14C ⑤CH3CH2CH2CH3 ⑥氯水
⑦ 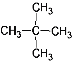 ⑧
⑧![]() ⑨C60。
⑨C60。
属于同素异形体的是__________(用序号回答,下同),属于同分异构体的是________,属于同位素的是______________。
(2)有a、MgBr2;b、金刚石;c、NaOH;d、干冰四种物质,按下列要求回答(用字母序号回答):
①熔化时不需要破坏化学键的是________,熔化时需要破坏共价键的是_________,熔点最高的是_____________。
②只有离子键的物质是___________,既有离子键又有共价键的物质是_________,晶体以分子间作用力结合的是______________。
(3)已知0.2mol烷烃在足量氧气中完全燃烧,测得生成CO2气体的体积为17.92L(标况下),则该烷烃的分子式为_________________,写出比该烃多1个碳的同系物,且其分子结构中含有3个甲基(-CH3)的结构简式______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(I)有下列各组微粒:(用①-⑤序号填空)
①12C和14C ②O2和O3 ③D2、T2 ④乙醇和二甲醚 ⑤冰和水
(1)互为同位素的是_________;
(2)互为同素异形体的是_________;
(3)互为同分异构体的是_________。
(II)写出下列微粒的电子式:
(4)NH4Cl______________。
(5)CaO2_____________。
(6)CCl4____________。
(III)写出下列微粒的结构式:
(7)N2______________。
(8)H2O_____________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com