
【题目】本世纪是生命科学研究的昌盛时期,科学家研究发现,进入生物体内的氧分子,可接受1个电子转变为超氧阴离子自由基(O2―),进而引发产生一系列自由基。一切需氧生物在其机体内均有一套完整的活性氧系统(抗氧化酶和抗氧化剂),能将活性氧转变为活性较低的物质,机体因此受到保护。人们利用羟胺(NH2OH)氧化的方法可以检测其生物系统中O2―含量,原理是O2―与羟胺反应生成NO2―和一种过氧化物。NO2―在对氨基苯磺酸和α—萘胺作用下,生成粉红的偶氮染料,该染料在λ=530nm处有显著吸收,且其吸收值与c(NO2―)成正比,从而可计算出样品中的O2―含量。某实验室用以上方法处理后测得溶液中:c(NO2―) =2.500×10-3 molL-1。
(1)请将测定原理有关的离子方程式缺少的物质补充完整并配平:
![]() NH2OH +
NH2OH +![]() O2― +
O2― +![]() H+=
H+=![]() NO2― +
NO2― +![]() +
+![]() H2O。
H2O。
(2)计算该样品中c(O2― ) = 。
(3)如用羟胺氧化法测定O2―时,将其生成的过氧化物作为检测物,若选用酸性K2Cr2O7溶液进行定量分析,请写出相应的离子方程式 。
(4)NO2―既有氧化性,又有还原性。NaNO2大量进入血液时,能将血红蛋白中的Fe2+氧化成Fe3+,正常的血红蛋白转化为高价铁血红蛋白,失去携氧功能,引起中毒,甚至死亡。下列各组试剂不能检验NO2―的是 。
A.FeCl2 KSCN B.KMnO4 H2SO4
C.AgNO3 HNO3 D.KI—淀粉试液
(5)某研究性学习小组,为研究光化学烟雾消长规律,在一烟雾实验箱中,测得烟雾的主要成分为RH(烃)、NO、NO2、O3、PAN(CH3COOONO2),各种物质的相对浓度随时间的消失,记录于右图,根据图中数据,请你判断下列推论中最不合理的是 。

A.NO的消失的速率比RH快 B.NO生成了NO2
C.RH及NO2可以生成PAN及O3 D.O3生成了PAN
【答案】
(1)NH2OH + 2O2― + H+= NO2― + H2O2 + H2O
(2)5.000×10-3 mol·L-1;
(3)Cr2O72-+3H2O2 + 8H+ =2Cr3+ +3O2↑+7H2O
(4)C;
(5)D
【解析】
试题分析:(1)O2-与羟胺(NH2OH)在弱酸性环境中反应生NO2-和一种过氧化物,根据质量守恒应为H2O2,NH2OH+2O2-+H+=NO2-+H2O2+H2O,故答案为:NH2OH + 2O2― + H+= NO2― + H2O2 + H2O;
(2)根据反应式:NH2OH+2O2-+H+=NO2-+H2O2+H2O,c(NH2OH):c(O2-)=1:2,则c(O2-)=2×2.500×1O-3mol/L=5.000×10-3mol/L,故答案为:5.000×10-3mol/L;
(3)Cr2O7具有氧化性,H2O2具有还原性,二者发生氧化还原反应生成Cr3+和O2,反应的离子方程式为:Cr2O72-+3H2O2+8H+=2Cr3++3O2↑+7H2O,故答案为:Cr2O72-+3H2O2+8H+=2Cr3++3O2↑+7H2O;
(4)NO2-既有氧化性,又有还原性;能将Fe2+氧化成Fe3+,A.加入FeCl2和KSCN时,NO2-将Fe2+氧化成Fe3+,所以溶液变红色,所以能用FeCl2和KSCN检验NO2-,故A正确;B.NO2-有还原性能使酸性高锰酸钾溶液褪色,所以能用KMnO4和H2SO4检验NO2-,故B正确;C.在含有NO2-溶液中加入AgNO3和HNO3无明显现象,所以不能检验,故C错误;D.NO2-有氧化性能把碘离子氧化为碘单质,使碘化钾淀粉溶液变蓝色,所以能用KI和淀粉检验NO2-,故D正确,故答案为:C;
(5)A、由曲线斜率可知在某一时间段内NO消失的速率比RH快,故A正确;B、NO的浓度一直在减少,NO2的浓度先增加后减少,在0-1时间段内NO可能生成NO2,故B正确;C、图中O3和PAN的浓度增加,RH的浓度减少,RH及NO2在某一时间段内可能反应生成PAN和O3,故C正确D、O3的浓度一直在增加,不可能作为反应物,故D错误,故选D。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】如图R、W、X、Y、Z为五种物质,若箭头表示能进一步转化的常见反应,则其中常温下能实现图示转化关系的是( )
选项 | R | W | X | Y | Z |
|
A | Si | SiO2 | H2SiO3 | NaSiO3 | SiCl4 | |
B | Na | Na2O | Na2O2 | Na2CO3 | NaOH | |
C | Fe | Fe(OH)2 | FeCl2 | FeCl3 | Fe(NO3)3 | |
D | Al | NaAlO2 | Al2(SO4)3 | AlCl3 | Al(NO3)3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D四种元素,原子序数依次增大,A原子的最外层上有4个电子;B的阴离子和C的阳离子具有相同的电子层结构,两元素的单质反应,生成一种淡黄色的固体E,D的L层电子数等于K、M两个电子层上的电子数之和。
(1)A为 ,B为 ,C为 ,D 。(填写相应的元素名称)
(2)写出由C、D两元素组成的化合物的电子式 。
(3)A的最高价氧化物的电子式 ,C的最高价氧化物水化物的电子式 , 淡黄色的固体E的电子式 。
(4)写出A、B的化合物与E反应的化学方程式: 。
(5)写出D元素的最高价氧化物的水化物和A的单质反应的化学方程式 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于化学反应与能量的说法正确的是
A. 中和反应是吸热反应 B. 燃烧属于放热反应
C. 化学键断裂放出能量 D. 反应物总能量与生成物总能量一定相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中,正确的是( )
A.反应产物的总能量大于反应物的总能量时,△H<0
B.已知反应H2 (g)+I2(g)![]() 2HI(g)平衡常数为K,则2H2 (g)+2I2(g)
2HI(g)平衡常数为K,则2H2 (g)+2I2(g)![]() 4HI(g)的平衡常数为2K
4HI(g)的平衡常数为2K
C.ΔH<0、ΔS>0的反应在温度低时不能自发进行
D.在其他外界条件不变的情况下,使用催化剂,不能改变化学反应进行的方向
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】体操运动员在完成单杠、吊环项目时常用“镁粉”搓手,以起到防滑效果。某种“镁粉”中可能含有Mg、MgO、Mg(OH)2、MgCO3中的一种或两种固体,实验小组对其成分展开了探究。
已知:MgO+2HCl=MgCl2+H2O MgCO3+2HCl=MgCl2+H2O+CO2↑
(1)探究“镁粉”中是否含有Mg和MgCO3
①取少量样品,如图所示进行实验。观察到a试管中有气泡产生,b试管中产生的现象是澄清石灰水变浑浊,则证明“镁粉”中一定含有______。

②为证明“镁粉”中是否含有Mg,小明将燃着的木条放在图中b试管口上方,木条熄灭。但同学们指出,该实验不能达成实验目的,需要将图中的澄清石灰水替换成浓NaOH溶液,目的是______________。小明按照修改后的实验方案重复上述实验,观察到b试管中无明显现象,证明“镁粉”中______________。
(2)探究“镁粉”中是否还含有MgO及Mg(OH)2
【实验过程】
Ⅰ.用MgO、Mg(OH)2和MgCO3三种固体分别做性质实验。分别取0.5g三种固体粉末,每次取样方法如图2所示:

逐滴加入相同溶质质量分数的稀盐酸直至粉末恰好消失。在下表中记录消耗的同浓度稀盐酸的体积(以下体积均在同一条件下测定,且保留到小数点后1位)
MgO | Mg(OH)2 | MgCO3 | |
消耗稀盐酸的体积 /mL | 10.4 | 7.2 | 5.0 |
Mg(OH)2与盐酸发生中和反应的化学方程式为_____________。
Ⅱ.取“镁粉”样品0.5 g,加入上述稀盐酸至粉末恰好溶解。此时消耗稀盐酸的体积约为5.3 mL。
【实验分析及结论】
“镁粉”不只含有MgCO3。理由是____________________________________。
【实验反思】
为确定“镁粉”的具体成分,同学们认为还需要补充如下实验:分别取0.5 g“镁粉”和0.5 g_________,加入足量稀盐酸,测定生成的气体体积分别为119mL和140mL。由此可知“镁粉”中含有MgCO3的质量分数为___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.SO2是硫酸工业尾气的主要成分。实验室中,拟用下图所示流程,测定标准状况下,体积为VL的硫酸工业尾气中SO2的含量:
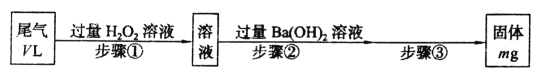
(1)步骤①中加入H2O2溶液时发生反应的离子方程式为______________________。
(2)一定温度下,BaSO4的沉淀溶解平衡曲线如图所示。步骤②逐滴加入Ba(OH)2溶液的过程中,BaSO4的溶度积常数__________(填“增大”、“减小”或“不变”),溶液中SO42-浓度的变化情况为____________(填序号)。
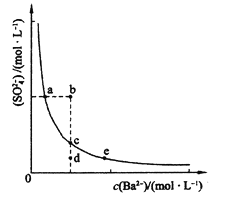
①d→c→e ②b→c→d
③a→c→e ④d→c→a
(3)该V L尾气中SO2的体积分数为________(用含有V、m的代数式表示)。
II.某烧碱样品含有少量不与酸作用的杂质,为了测定其纯度,进行以下操作:
A.在250 mL的容量瓶中准确配制250 mL烧碱溶液
B.用碱式滴定管移取25 mL烧碱溶液于锥形瓶中并滴入2滴甲基橙指示剂
C.在天平上准确称取烧碱样品m g,在烧杯中用蒸馏水溶解
D.将浓度为c mol·L-1的标准硫酸装入酸式滴定管,调整液面记下开始读数V1
E.在锥形瓶下垫一张白纸,滴定至橙色为止,记下读数V2
就此实验完成下列填空:
①正确的操作步骤的顺序是(用编号字母填写):________________。
②取碱液过程中眼睛应注视_______________________。
③滴定操作中,锥形瓶残留少量蒸馏水,则测得的结果__________(填“偏大”、“偏小”或“不变”,下同);达到滴定终点时,尖嘴处尚有一滴液滴未滴下,则测得的结果____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关溶液的存储和配制的描述不正确的是
A. 氨水易挥发,应密封在低温处保存
B. 水玻璃可存放在橡胶塞的细口瓶中
C. 配制FeCl3溶液,先加浓盐酸溶解氯化铁固体,再稀释至相应浓度
D. 称取2.5g硫酸铜晶体,溶于l00mL水中可以配制物质的量浓度为0.1mol·L—1的硫酸铜溶液
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com