
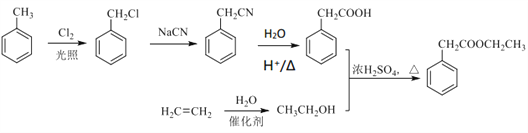
����Ŀ����ͪ���������K���п������������ã��ϳ�·���������ͼ��ʾ:

��֪�����л�������ת���ķ�Ӧʽ����:
��. ![]() ��R������
��R������
��. ![]() ��R��R�����������⣩
��R��R�����������⣩
��.  ��R�����������⣩
��R�����������⣩
��ش�
(1)A�Ľṹ��ʽ_______����˴Ź����������շ������Ϊ________��
(2)F�Ľṹ��ʽ_______��C��D�ķ�Ӧ����Ϊ_______��
(3)G���Լ�b��Ӧ�Ļ�ѧ����ʽΪ______________��
(4)������������D��ͬ���칹�干��_____�֡�
���ܷ���������Ӧ �ڷ����к������� �۱�����������ȡ����
д���������������ұ����ϵ�һ��ȡ����ֻ�����ֵ�ͬ���칹��Ľṹ��ʽ______��
(5)��A ����ϩΪ��ʼԭ�ϣ����������Ϣ��ѡ�ñ�Ҫ�����Լ���Ƴ��ϳɱ���������(![]() )�ļ�����ͼ______��(���Լ���ѡ)
)�ļ�����ͼ______��(���Լ���ѡ)
���𰸡�  3:2:2:1
3:2:2:1 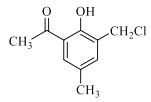 ȡ��
ȡ�� 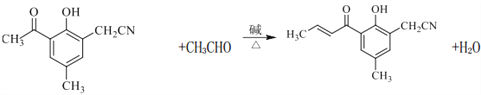 6
6 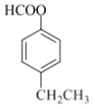 ��
��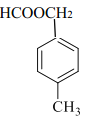
����������1����B�ķ���ʽ��C�Ľṹ��ʽ��A��B��C��ת����ϵ�ɵã�AΪ�ױ�����ṹ��ʽΪ��![]() ����������4�ֲ�ͬ��ѧ��������ԭ�ӣ��ֱ�Ϊ���ϵ�3����ԭ�ӡ������������λ�ϵ�2����ԭ�ӡ������������λ�ϵ�2����ԭ�ӡ������������λ�ϵ�1����ԭ�ӣ�����˴Ź����������շ������Ϊ3:2:2:1��
����������4�ֲ�ͬ��ѧ��������ԭ�ӣ��ֱ�Ϊ���ϵ�3����ԭ�ӡ������������λ�ϵ�2����ԭ�ӡ������������λ�ϵ�2����ԭ�ӡ������������λ�ϵ�1����ԭ�ӣ�����˴Ź����������շ������Ϊ3:2:2:1��
��2����E��G�Ľṹ��ʽ��F�ķ���ʽ��E��F��G��ת����ϵ�ɵã�F�Ľṹ��ʽΪ��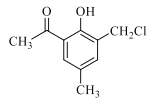 ����������C��D�Ľṹ��ʽ����Ӧ�����ɵã�C����ȡ����Ӧ����D��
����������C��D�Ľṹ��ʽ����Ӧ�����ɵã�C����ȡ����Ӧ����D��
��3��H������Ӧ������J����J�Ľṹ��ʽ�������֪���ɵã�HΪ��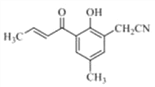 ��G(
��G(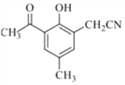 )���Լ�b������������·�Ӧ����H�������֪���ɵã��Լ�bΪ��ȩ����G���Լ�b��Ӧ�Ļ�ѧ����ʽΪ��
)���Լ�b������������·�Ӧ����H�������֪���ɵã��Լ�bΪ��ȩ����G���Լ�b��Ӧ�Ļ�ѧ����ʽΪ�� +CH3CHO
+CH3CHO![]()
 +H2O��
+H2O��
��4����D�Ľṹ��ʽ�ɵ÷���ʽΪC9H10O2����ͬ���칹�������ܷ���������Ӧ������ȩ�����ڷ����к�����������ӦΪ���������۱�����������ȡ������������ȡ����������һ����HCOO-����һ���һ���Ҳ������һ����HCOOCH2-����һ����������ȡ�����������ڡ��䡢������λ�ù�ϵ��������������D��ͬ���칹�干��6�֣����б����ϵ�һ��ȡ����ֻ�����ֵ�ͬ���칹�壬����ȡ����ӦΪ��λ��ϵ����ṹ��ʽΪ��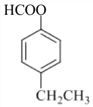 ��
��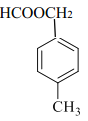 ��
��
��5���Լױ�����ϩΪ��ʼԭ�ϣ�Ҫ�ϳɱ����������������ñ��������Ҵ�����������Ӧ����ϩ������ȡ�Ҵ�������֪���ɵã�����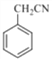 ��ȡ�����ᣬ��
��ȡ�����ᣬ��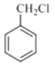 ��ȡ
��ȡ ���ױ�������������������ȡ����Ӧ������
���ױ�������������������ȡ����Ӧ������ �����Ϸ�����������ͼΪ��
�����Ϸ�����������ͼΪ��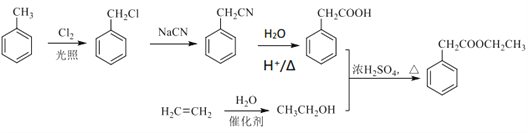 ��
��


 ��У����ϵ�д�
��У����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������в�����̼̼������̼̼˫������Ľṹ��������Ϊ֤�ݵ���ʵ��( )
�ٱ�����ɫ�ӷ���Һ�壻
�ڱ�����ʹ���Ը��������Һ��ɫ��
��![]() ��
�� ��ͬһ�����ʡ�
��ͬһ�����ʡ�
A. �٢ڢ� B. �ٺ͢� C. �ٺ͢� D. �ں͢�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���״��������ȡ��ȩCH3OH��g��HCHO��g��+H2��g����H���״���ƽ��ת�������¶ȱ仯��������ͼ��ʾ�������й�˵����ȷ���ǣ������� 
A.��H��0
B.��Y�㵽Z���ͨ�������¶�ʵ��
C.��Y�㵽X���ͨ��ʹ�ô���ʵ��
D.600 Kʱ��Y��״���v����v��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij�¶��£���һ�����0.1mol/LһԪ����HA��Һ����μ����Ũ�ȵ�NaOH ��Һ����Һ��pH��pOH[pOH=-lgc(OH-) �ı仯��ϵ����ͼ��ʾ������˵���������

A. ���¶��£�ˮ�����ӻ�����Ϊ1.0��10-2a
B. M��N ������ʾ����Һ�У�ˮ�ĵ���̶���ͬ
C. Q�����ĵ�NaOH ��Һ���������HA ��Һ�����
D. N ����Һ��ˮϡ�ͣ�![]() ��С
��С
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ҵ��ˮ�г�����һ������Cr2O72����CrO42�� �� ���ǻ�����༰��̬ϵͳ������H+��ת�� Fe2+�ڻ�ԭ OH���۳�������˺���������д��������õĴ��������л�ԭ���������÷��Ĺ�������Ϊ��CrO42�� ![]() Cr2O72��
Cr2O72�� ![]() Cr3+
Cr3+ ![]() Cr��OH��3���еڢٲ�����ƽ�⣺2CrO42������ɫ��+2H+Cr2O72������ɫ��+H2O
Cr��OH��3���еڢٲ�����ƽ�⣺2CrO42������ɫ��+2H+Cr2O72������ɫ��+H2O
��1����ƽ����ϵ��pH=2������Һ��ɫ��
��2���ڢڲ��У���ԭ1mol Cr2O72�����ӣ���Ҫmol��FeSO47H2O��
��3��Cr3+��Al3+�Ļ�ѧ�������ƣ���Cr2��SO4��3��Һ����μ���NaOH��Һֱ���������ɹ۲쵽�������� �� �ڢ۲����ɵ�Cr��OH��3����Һ�д������³����ܽ�ƽ�⣺Cr��OH��3��s��Cr3+��aq��+3OH����aq��
��4�������£�Cr��OH��3���ܶȻ�Ksp=c��Cr3+��c3��OH����=10��32 �� Ҫʹc��Cr3+������10��5mol/L����Һ��pHӦ���� ��
��5����֪AgCl��Ag2CrO4��ש��ɫ����Ksp�ֱ�Ϊ2��10��10��1.12��10��12 �� ������ѧ�У��ⶨ���ȵ�������Һ��Cl���ĺ�������K2CrO4��ָʾ������AgNO3��Һ�ζ����ζ������������������� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��
A. C��H��O��N��Fe��P B. H��O��K��S��P��Mg
C. C��P��O��S��H��N D. N��P��K��Ca��S��Zn
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������������ijֲ������Һʱʹ����NH4NO3��KNO3��CaCl2��MgSO4����Ԫ����Һ����ȱ����һ�ֱ����Ԫ�أ�Ϊ��������Ԫ�أ�Ӧ���ӵĻ�������
A. Ca(NO3)2 B. KCl C. KH2PO4 D. K2SO4
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����Ȼ�����(POCl3)�������뵼����Ӽ���ʵ������ȡPOCl3���ⶨ��Ʒ������ʵ��������£��ݴ˻ش�����������
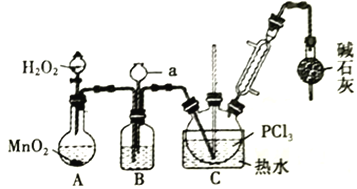
��.����Һ̬PCl3���Ʊ�POCl3��
����i���й��Լ������ʼ�ʵ��װ�������ȼ��г�װ��ʡ����������
���� | �۵�/�� | �е�/�� | ��Է������� | ���� |
PCl3 | -112.0 | 76.0 | 137.5 | ���߾�Ϊ��ɫҺ�壬��ܽ⣻��ˮ������ˮ��Ϊ�����ᡣ |
POCl3 | 2.0 | 106.0 | 153.5 |
��1��A �з�Ӧʱ��MnO2��������_________________������a������Ϊ_________________��
��2��ʢ��Ũ�����װ��B�������ó��۲�O2������֮��������_________________��
��3��ʵ��ʱӦ���Ʒ�Ӧ�¶���60~65�����¶Ȳ��˹��ߵ�ԭ����_________________��;�����ȥװ�м�ʯ�ҵĸ����������ܽ���POCl3�IJ�����ԭ����_________________________________(�û�ѧ����ʽ��ʾ����дһ��)��
��.�����ζ����ⶨPOCl3������
����ii ��Ag3PO4Ϊ��ɫ������������������
iii��Ag++SCN-=AgSCN������Ksp(AgSCN) <Ksp(AgCl)��
ʵ�鲽��������
����������ƿ�еIJ�ƷPOCl3ȥ������������60.00mL����ˮ��������ʹ����ȫˮ������ˮ��Һ���100.00mL��Һ��
��ȡ10.00mL��Һ����ƿ�У�����10.00mL 3.8mol/L AgNO3����Һ��
����������������������ҡ����ʹ�������渲����������
������2~3 ����������Һ��ָʾ������0.2mol/L KSCN��Һ�ζ�������AgNO3��Һ�������յ�ʱ����ȥ10,00mL KSCN��Һ��
��4���ﵽ�յ�ʱ��������______________________________��
��5�����ò�ƷPOCl3������Ϊ____________(���������λС��)����ȡ���������������ý����______________��� ƫ�ߡ����� ƫ�͡����䡱����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���±��Ǽ������᳣���µĵ���ƽ�ⳣ����
CH3COOH | H2CO3 | H2S | H3PO4 |
1.8��10��5 | K1=4.3��10��7 | K1=9.1��10��8 | K1=7.5��10��3 |
������˵���в���ȷ���ǣ�������
A.̼�������ǿ��������
B.��Ԫ�����������Ҫ�ɵ�һ���������
C.�����£���ˮϡ�ʹ��ᣬ ![]() ����
����
D.��������Һ�м�����NaOH��Һ�����볣������
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com