
【题目】某些芳香族化合物的分子式均为C7H8O,其中与FeCl3溶液混合后,显紫色和不显紫色的种类分别为( )
A.2种和1种B.2种和3种C.3种和2种D.3种和1种
 发散思维新课堂系列答案
发散思维新课堂系列答案科目:高中化学 来源: 题型:
【题目】下列实验操作规范且能达到目的的是
目的 | 操作 | |
A. | 取20.00 mL盐酸 | 在50 mL酸式滴定管中装入盐酸,调整初始读数为30.00 mL后,将剩余盐酸放入锥形瓶 |
B. | 测定醋酸钠溶液pH | 用玻璃棒蘸取溶液,点在湿润的pH试纸上 |
C. | 清洗碘升华实验所用试管 | 先用酒精清洗,再用水清洗 |
D. | 配制浓度为0.010 | 称取KMnO4固体0.158 g,放入100 mL容量瓶中,加水溶解并稀释至刻度 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高温下,某反应达平衡,平衡常数K=![]() 。恒容时,温度升高,H2浓度减小。下列说法正确的是
。恒容时,温度升高,H2浓度减小。下列说法正确的是
A、该反应的焓变为正值
B、恒温恒容下,增大压强,H2浓度一定减小
C、升高温度,逆反应速率减小
D、该反应化学方程式为CO+H2O=CO2+H2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)反应m A+n B ![]() p C在某温度下达到平衡。
p C在某温度下达到平衡。
①若A、B、C都是气体,减压后正反应速率小于逆反应速率,则m、n、p的关系__________。
②若A、B、C都是气体,且m + n < p,而加压或升温平衡移动方向相同,则△H ______0
(2)将1molN2和4molH2充入容积为2L的密闭容器中发生:N2(g)+ 3H2(g) ![]() 2NH3(g) ,2分钟后反应达平衡后,N2的浓度为0.25 mol/L,完成:
2NH3(g) ,2分钟后反应达平衡后,N2的浓度为0.25 mol/L,完成:
①N2转化率是____________
②用NH3 表达的化学反应速率为:___________
③平衡常数值是________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】回答下列问题:
(1)实验室在临时配制一些氯化铁溶液时,常将氯化铁固体先溶于较浓的盐酸中,然后再用蒸馏水稀释到所需的浓度,是为了_________________(填“促进”、“抑制”)水解。氯化铁水溶液呈______(填“酸”、“中”、“碱”)性,常温时的pH _____7(填“>”、“=”、“<”),原因是(用离子方程式表示):______________________________。
(2)常温下,pH=2的某酸HnA(A为酸根)与pH=12的某碱B(OH)m等体积混合,恰好反应生成正盐,混合溶液的pH=10.反应生成正盐的化学式为___________ ,该盐中___________(填离子符号)一定能水解,其水解的离子方程式为____________________.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】运用相关原理,回答下列各小题:
I.已知:硫酸氢钠在水中的电离方程式为___________________________
(1)常温下,pH=5的硫酸氢钠溶液中水的电离程度______pH=9的一水合氨中水的电离程度。(填“>”、”=”或“<”)
(2)等体积等物质的量浓度的硫酸氢钠与氨水混合后,溶液呈酸性的原因为______。(用离子方程式表示);若一定量的硫酸氢钠溶液与氨水混合后,溶液pH=7,则c(Na+)+c(NH4+)___2c(SO42-)(填“>”、“=”或“<”不同);用硫酸氢钠与氢氧化钡溶液制取硫酸钡,若溶液中SO42-完全沉淀,则反应后溶液的PH_____7(填“>”、”=”或“<”)
II.25℃时,电离平衡常数:
化学式 | CH3COOH | H2CO3 | HClO |
电离平衡常数 | 1.8×10-5 | K1 4.3×10-7 K2 5.6×10-11 | 3.0×10-8 |
(1)物质的量浓度为0.1mol/L的下列四种物质:a.Na2CO3,bNaClO,c.CH3COONa d.NaHCO3;pH由大到小的顺序是:_______________________;(填编号)
(2)25℃时,CH3COOH与CH3COONa的混合溶液,若测得混合液pH=6,则溶液中,c(CH3COO-)-c(Na+)=_____________。(填准确数值)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E是五种短周期元素。已知:它们的原子序数依次增大,A是元素周期表中原子半径最小的元素;B原子最外层电子数比其次外层电子数多2,C是E的邻族元素;D和E的原子序数之和为30,且D的族序数与周期数相等。甲、乙、丙、丁是它们两两形成的化合物,其中甲分子中含有18个电子。
物质组成 | 甲 | 乙 | 丙 | 丁 |
化合物中各元素原子个数比 | A和C 1:1 | B和A 1:4 | D和E 1:3 | B和E 1:4 |
请回答下列问题:
(1)若元素E的某种核素中中子数比质子数多3个,表示这种核素的符号为___________;
(2)把D的单质放到NaOH溶液中,反应的离子方程式为:______________________;
(3)甲的电子式:____________________________________________;
(4)有100mL MgCl2和丙的混合溶液,其中c(Mg2+)=0.2mol·L-1,c(Cl-)=1.3mol·L-1,要使Mg2+全部转化为沉淀分离出来,至少需要4mol·L-1NaOH溶液的体积是:________mL;
(5)在密闭容器中充入BC2、BC和乙的混合气体共mg,若加入足量Na2O2,并不断用电火花点燃至反应完全,测得固体质量增重mg,则BC2与乙的质量比为__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列过程或现象与盐类水解无关的是( )
A.纯碱溶液去油污B.铁在潮湿的环境下生锈
C.加热氯化铁溶液颜色变深D.0.1 mol/L AlCl3溶液中c(Al3+)<0.1 mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】色酮类化合物K具有抗菌、降血脂等生理活性,其合成路线如下:
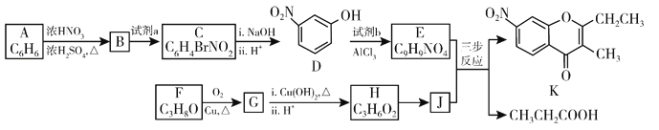
已知:
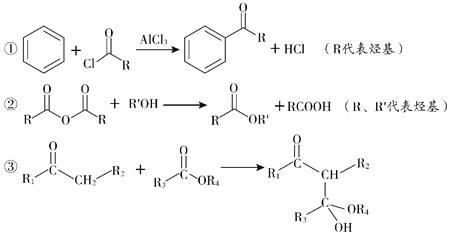
(R、R1、R2、R3、R4代表烃基)
(1)A的结构简式是________;根据系统命名法,F的名称是________。
(2)B→C所需试剂a是________;试剂b的结构简式是____________。
(3)C与足量的NaOH反应的化学方程式为____________。
(4)G与银氨溶液反应的化学方程式为___________。
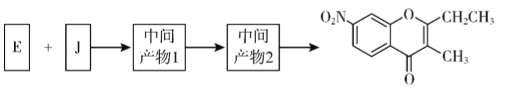
(5)已知:①2H ![]() J+H2O; ②J的核磁共振氢谱只有两组峰。以E和J为原料合成K分为三步反应,写出下列化合物的结构简式:____________
J+H2O; ②J的核磁共振氢谱只有两组峰。以E和J为原料合成K分为三步反应,写出下列化合物的结构简式:____________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com