
【题目】下列反应的离子方程式正确的是( )
A.氨气通入醋酸溶液中CH3COOH+NH3= CH3COONH4
B.氢氧化钠与氯化铵溶液混合加热:![]() +OH-= NH3·H2O
+OH-= NH3·H2O
C.氨水中加盐酸:NH3·H2O+H+=![]() +H2O
+H2O
D.硫酸铵与氢氧化钡溶液:![]() +OH-= NH3·H2O
+OH-= NH3·H2O
【答案】C
【解析】
A. 氨气通入醋酸溶液中生成醋酸铵,铵盐易溶于水,应该拆成铵根离子和醋酸根离子,离子反应为:CH3COOH+NH3= CH3COO-+NH4+,故A错误;
B.氢氧化钠与氯化铵溶液混合加热会有氨气逸出,必须写成氨气形式,离子反应为:![]() +OH-= NH3↑+H2O,故B错误;
+OH-= NH3↑+H2O,故B错误;
C. 氨水中加盐酸生成氯化铵和水,离子反应为:NH3·H2O+H+=![]() +H2O,故C正确;
+H2O,故C正确;
D.硫酸铵与氢氧化钡溶液反应生成氨气、水和硫酸钡,硫酸钡不溶于水,不能拆成离子,生成物中要有硫酸钡出现,离子反应为:2![]() +SO42-+2OH-+Ba2+=2NH3·H2O+ BaSO4↓, D错误;
+SO42-+2OH-+Ba2+=2NH3·H2O+ BaSO4↓, D错误;
答案选C。


 优等生题库系列答案
优等生题库系列答案科目:高中化学 来源: 题型:
【题目】某兴趣小组制备一定量的乙酸乙酯.取3mL无水乙醇,2mL浓硫酸,2mL冰醋酸进行实验,用5mL饱和碳酸钠溶液收集产物。
I.实验装置如图所示
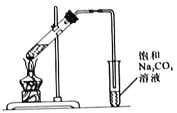
(1)制备乙酸乙酯的化学方程式为_______________。
(2)浓硫酸的作用是_______________。
(3)长导管的作用是_______________。
(4)接收装置还可选择下图中的___________。(填序号).
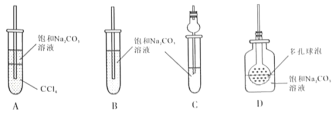
Ⅱ.甲同学用含有酚酞的饱和碳酸钠溶液(呈碱性)收集产物后振荡,发现红色迅速退去.
甲同学认为是蒸出的乙酸中和了碳酸钠.乙同学通过查阅资料并进行如下实验,证明甲同学的推测是错误的。
已知:酚酞难溶于水,易溶于有机溶剂;酚酞试剂是酚酞的乙醇溶液.
实验i,取振荡后的下层无色液体,分成两份,分别完成以下实验
序号 | 实验操作 | 实验现象 | 结论 |
1 | 滴加几滴酸酞试剂 | 溶液 ① (填“变红”成“不变红”) | 碳酸钠并未被乙酸完全中和,仍有大量剩余 |
2 | 滴入乙酸溶液 | 有大量气泡产生 |
实验ii.取振荡后的上层液体,加入 ② 溶液,振荡,发现出现浅红色,静置分层后红色消失。
实验iii,取5mL饱和碳酸钠溶液,滴入几滴酚酞试剂,再加入3mL乙酸乙酯(不含乙酸)振荡,溶液先变红,振荡后红色消失。回答下列问题
(5)完成上述实验:①_______________。②_______________。
(6)结合实验ii和实验iii的现象,可得出的结论是_______________。
(7)实验iii的实验目的是_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,在10 L密闭容器中加入5 mol SO2和3 mol O2,发生反应:2SO2(g)+O2(g)![]() 2SO3(g),10 min时,反应达到平衡状态,此时有3 mol SO2发生了反应。
2SO3(g),10 min时,反应达到平衡状态,此时有3 mol SO2发生了反应。
(1)反应生成了________ mol SO3,v(SO2)=________。
(2)平衡时SO3的浓度是________,SO2的转化率是________。
(3)平衡时容器内气体的总物质的量为________mol。
(4)物质的浓度不再改变标志着该反应已达平衡,下列还可以说明该反应已达平衡的是______(填序号)。
①体系内压强不再改变 ②容器内气体的密度不再改变
③混合气体的平均相对分子质量不再改变
④v正(SO3)=2v逆(O2) ⑤n(SO3)∶n(O2)∶n(SO2)=2∶1∶2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在50 mL 4 mol·L-1的氢氧化钠溶液中,通入一定量的硫化氢,反应完毕,在常温减压条件下,用氮气把溶液吹干,得到白色固体7.92 g,通过计算确定白色固体的组成及各组分的质量。_________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】醋酸亚铬水合物[Cr(CH3COO)2]22H2O (相对分子质量为376)是一种氧气吸收剂,为红棕色晶体,潮湿时易被氧化,微溶于乙醇,不溶于水和乙醚(易挥发的有机溶剂)。其制备装置及步骤如下:
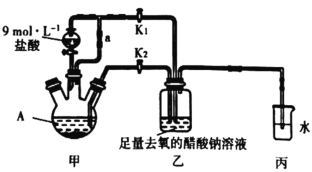
①________________________________________。
②往装置A中依次加入过量锌粒、适量CrCl3溶液。
③关闭K2,打开K1,旋开分液漏斗的旋塞并控制好滴速。
④待A内的溶液由深绿色(Cr3+)变为亮蓝色(Cr2+)时,将溶液转移至装置乙中,当出现大量红棕色晶体时,关闭分液漏斗的旋塞。
⑤将装置乙中混合物快速过滤、洗涤和干燥,称量得到[Cr(CH3COO)2]22H2O。
(1)实验步骤①进行什么操作______________________________。
(2)装置A的名称__________________。
(3)写出装置A中反应的离子方程式为__________________,___________________________。
(4)实现步骤①中溶液自动转移至装置乙中的实验操作为__________________。
(5)步骤③目的是_____________________________________________。
(6)洗涤产品时,依次用去氧的冷蒸馏水、无水乙醇、乙醚,目的是__________________。
(7)已知其它反应物足量,实验时取用的CrCl3溶液中含溶质12.68g,实验后得干燥纯净的[Cr(CH3COO)2]22H2O 11.28g,则该实验所得产品的产率为_______(不考虑溶解的醋酸亚铬水合物)(用百分数表示,保留3位有效数字)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某一元弱酸(用HA表示)在水中的电离方程式是HA![]() H++A-,回答下列问题:
H++A-,回答下列问题:
(1)向纯水中加入适量HA,水的电离平衡将向___(填“正”、“逆”)反应方向移动,理由是____。
(2)在25℃下,将a mol·L-1的氨水与0.01mol·L-1的盐酸等体积混合,反应平衡时溶液中c(NH4+)=c(Cl-),则溶液显__性(填“酸”、“碱”或“中”),a___0.01(填“大于”、“小于”或“等于”);用含a的代数式表示NH3·H2O的电离常数Kb=__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将4molA气体和 2 mol B 气体在 2 L 的容器中混合并在一定条件下发生如下反应:2A(气)+B(气)![]() 2C(气),若经2s(秒)后测得C的浓度为0.6mol·L-1 ,现有下列几种说法,其中正确的是( )
2C(气),若经2s(秒)后测得C的浓度为0.6mol·L-1 ,现有下列几种说法,其中正确的是( )
A.用物质A表示的反应的平均速率为3mol·L-1·s-1
B.用物质B表示的反应的平均速率为0.6mol·L-1·s-1
C.2s时物质A的转化率为70%
D.2s时物质B的浓度为0.7mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某稀硫酸和稀硝酸的混合溶液200 mL,平均分成两份.向其中一份中逐渐加入铜粉,最多能溶19.2 g(已知硝酸只被还原为NO气体)。向另一份中逐渐加入铁粉,产生气体的量随铁粉质量增加的变化如图所示。下列分析或结果不正确的是( )
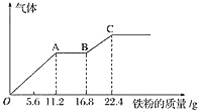
A.图中,AB段的反应为Fe+2Fe3+=3Fe2+,溶液中溶质最终为硫酸亚铁
B.原溶液中硫酸浓度为2.5 mol·L-1
C.原混合溶液中硝酸根离子的物质的量为0.4 mol
D.图中,OA段产生的气体是一氧化氮,BC段产生的气体是氢气
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某课外活动小组实验测得某硅酸盐所含氧化物的质量分数如下表:
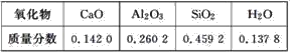
根据表中的数据请写出
(1)该硅酸盐的普通化学式是______________。
(2)用氧化物的形式表示该硅酸盐的组成是____________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com