
【题目】下列物质的分子中既有σ键,又有π键,并含有非极性键的是( )
①H2O2 ②N2 ③H2O ④HCl ⑤C2H4 ⑥C2H2
A. ②⑤⑥ B. ①②⑤⑥ C. ②③④ D. ②④⑥
【答案】A
【解析】
共价单键为σ键,共价双键中一个是σ键一个是π键,共价三键中一个是σ键两个是![]() 键,同种元素之间形成非极性共价键,据此分析。
键,同种元素之间形成非极性共价键,据此分析。
①H2O2中存在H-O和O-O键,只有σ键,故错误;
②N2的结构式为N≡N,含有σ键和π键,N与N之间为非极性键,故正确;
③H2O中只存在H-O,即只有σ键,故错误;
④HCl的结构式为H-Cl,所以只存在σ键,故错误;
⑤C2H4的中氢原子和碳原子之间存在共价单键、碳碳之间存在共价双键,含有σ键和π键,C与C之间为非极性键,故正确;
⑥C2H2的中氢原子和碳原子之间存在共价单键、碳碳之间存在共价三键,所以含有σ键和π键,C与C之间为非极性键,故正确;
综上所述,②⑤⑥符合题意,本题选A。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】实验室可用KMnO4和浓盐酸反应制取氯气。
KMnO4+HCl(浓)=KCl+MnCl2+Cl2↑+H2O(未配平)
(1)配平化学方程式,并用单线桥标出电子转移的方向和数目。
(2)将上述配平的化学方程式改写为离子方程式 。
(3)浓盐酸在反应中显示出来的性质是________________
①只有还原性 ②还原性和酸性
③只有氧化性 ④氧化性和酸性
(4)若产生0.5molCl2,则被氧化的HCl mol,转移的电子的数目约为___________。
(5)一定条件下,KMnO4还可以氧化其他还原性物质。
MnO4-+C2O42-+ = Mn2+ +CO2↑+
完成上述离子方程式,此反应中,发生氧化反应的物质是 ;若转移1mol电子,生成标准状况下CO2 L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以有机物A(含有苯环的烃,化学式C8H8)和CCl4为原料合成苯丙氨酸E的流程如下:

已知:烃分子中的氢原子被卤素原子取代所生成的衍生物叫做卤代烃,如CH3CH2Cl;卤代烃在NaOH水溶液加热条件下会水解,如:
CH3CH2Cl+NaOH![]() CH3CH2OH+NaCl
CH3CH2OH+NaCl
CH2ClCH2Cl+2NaOH![]() CH2OHCH2OH+2NaCl
CH2OHCH2OH+2NaCl
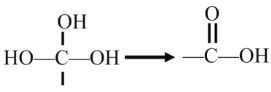 (该反应不需要条件就迅速转化)
(该反应不需要条件就迅速转化)
R-CH2CH2OH![]() R-CH=CH2+H2O
R-CH=CH2+H2O
(1)D→E的反应类型为_____________________。
(2)A的结构简式为________________________。
(3)有关D的叙述错误的是___________(填序号)。
a.能使酸性KMnO4溶液褪色 b.能与溴的CCl4溶液反应
c.能与甲醇发生酯化反应 d.能发生水解反应
(4)C→D反应的化学方程式为___________________________________。
(5)满足下列条件的E的同分异构体共有_________种。
①属于酯类;②苯环上只有两个对位取代基,其中一个为—NH2。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,在固定体积的密闭容器中发生下列反应:2HI![]() H2+I2。若c(HI)由0.1 mol·L-1降到0.07 mol·L-1时,需要15 s,那么c(HI)由0.07 mol·L-1降到0.05 mol·L-1时,所需反应的时间为 ( )
H2+I2。若c(HI)由0.1 mol·L-1降到0.07 mol·L-1时,需要15 s,那么c(HI)由0.07 mol·L-1降到0.05 mol·L-1时,所需反应的时间为 ( )
A. 5 sB. 10 sC. 大于10 sD. 小于10 s
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某种浓差电池的装置如下图所示,碱液室中加入电石渣浆液[主要成分为Ca(OH)2],酸液室通入CO2(以NaCl为支持电解质),产生电能的同时可生产纯碱等物质。下列叙述错误的是( )

A. 电子由M极经外电路流向N极
B. N电极区的电极反应式为2H++2e-=H2↑
C. 在碱液室可以生成 NaHCO3、Na2CO3
D. 放电一段时间后,酸液室溶液pH增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示晶体结构是一种具有优良的压电、电光等功能的晶体材料的最小结构单元(晶胞)。晶体内与每个“Ti”紧邻的钡原子数和这种晶体材料的化学式分别是(各原子所带电荷均已略去)( )

A. 8;BaTi8O12 B. 8;BaTiO3 C. 3;BaTi2O3 D. 6;BaTiO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】R、X、Y和Z是四种元素,其常见化合价均为+2价,且X2+与单质R不反应,X2++Z=X+Z2+,Y+Z2+=Y2++Z。这四种离子被还原成0价时,表现的氧化性强弱顺序为( )
A.R2+>X2+>Z2+>Y2+B.X2+>R2+>Y2+>Z2+
C.Y2+>Z2+>R2+>X2+D.Z2+>X2+>R2+>Y2+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是元素周期表的一部分:

(1)元素⑩原子结构示意图为__________.
(2)元素③④的第一电离能大小关系为_______(填化学用语,下同),原因是__________________。④-⑧中最高价氧化物对应水化物酸性最强的是_______.
(3)写出元素⑦的最高价氧化物与NaOH溶液反应的离子方程式_________。
(4)元素⑤ 与⑧ 元素相比,非金属性较强的是__________(用元素符号表示),下列表述中能证明这一事实的是__________。
A.气态氢化物的挥发性和稳定性
B.两元素的电负性
C.单质分子中的键能
D.含氧酸的酸性
E.氢化物中X—H键的键长
F.两单质在自然界中的存在形式
(5)根据下列五种元素的第一至第四电离能数据(单位:KJ·mol﹣1),回答下面各题:
元素代号 | I1 | I2 | I3 | I4 |
Q | 2080 | 4000 | 6100 | 9400 |
R | 500 | 4600 | 6900 | 9500 |
S | 740 | 1500 | 7700 | 10500 |
T | 580 | 1800 | 2700 | 11600 |
U | 420 | 3100 | 4400 | 5900 |
①T元素最可能是________(填“s”、“p”、“d”、“ds”等)区元素;
在周期表中,最可能处于同一主族的是_________.(填元素代号),
②下列离子的氧化性最弱的是______________。
A.S2+ B.R2+ C.U+ D.T3+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室需要配制1.0mol/L的氢氧化钠溶液480mL。完成下列各题。
(1)应选择规格为__mL的容量瓶,该容量瓶上除注明规格外,还标有_____(选填编号)。
a.温度 b.浓度 c.压强 d.刻度线
(2)用电子天平称取_____gNaOH。
(3)将称好的氢氧化钠固体加_____将其溶解,待冷却后将溶液移入容量瓶中。
(4)用少量蒸馏水冲洗____2~3次,将洗液移入容量瓶中。
(5)向容量瓶内加水至接近刻度1~2cm处,改用胶头滴管小心地加水至______________。
(6)最后塞好瓶塞,摇匀,将配好的溶液移入__(选填编号)中并贴好标签。
a.  b.
b.  c.
c.  d.
d. 
(7)分析下列操作可能会对氢氧化钠溶液浓度造成的影响(填“偏高”、“偏低”或“无影响”)。
①氢氧化钠溶解后,未冷却即转移___。
②定容时仰视_____。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com