
【题目】C、N、O、Al、Si 、Cl、Fe是七种常见元素
(1)N元素位于周期表第 周期,第 族。
(2)用“>”、“<”或“= ”填空:
离子半径 | 得电子能力 | 酸性 | 金属性 |
O2― Al3+ | 16O 18O | H2CO3 HNO3 | Fe Al |
(3)SiO2及硅酸盐在自然界广泛存在,在日常生活、生产、科研及新型材料等方面有着重要的用途。高岭土[Al2(Si2O5)(OH)4]改写成氧化物的形式为 。
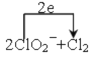
(4)ClO2常用于水的净化,工业上可用Cl2氧化NaClO2溶液制取ClO2。写出该反应的离子方程式,并用单线桥标出电子转移的方向和数目: 。
(5)将铝片(表面除去氧化膜)与碳棒用导线连接后插入稀NaOH溶液中可以构成原电池,电池正极为 ,电池负极反应的电极方程式为 。
【答案】(1)二、ⅤA (2)>、=、<、< (3)Al2O3·2SiO2·2H2O
(4)
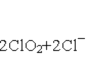 (5)碳棒 Al-3e—+4OH—=AlO2—+2H2O
(5)碳棒 Al-3e—+4OH—=AlO2—+2H2O
【解析】试题分析:(1)N原子核外有7个电子,分为2层,最外层5个电子,则N元素位于周期表第二周期,第ⅤA族。
(2)氧离子和铝离子的核外电子排布相同,铝的核电荷数大,则离子半径:O2―>Al3+;同一元素的不同核素,最外层电子数相同,化学性质相同,得电子能力:16O=18O;非金属性:C<N,非金属性越强,最高价含氧酸的酸性越强,则酸性:H2CO3< HNO3;铝比铁活泼,则金属性:Fe<Al。
(3)硅酸盐改写成氧化物形式的一般原则是:活泼金属氧化物不活泼金属氧化物非金属氧化物SiO2H2O,则高岭土[Al2(Si2O5)(OH)4]改写成氧化物的形式为Al2O3·2SiO2·2H2O。
(4)Cl2氧化NaClO2溶液制取ClO2,根据“价态归中”原则,ClO2-中Cl元素的化合价由+3价失电子生成ClO2中的+4价Cl,所以用线桥标出电子转移的方向和数目为![]() 。
。
(5)铝、C和氢氧化钠溶液构成的原电池,反应原理为:2Al+2NaOH+2H2O=2NaAlO2+3H2↑,铝失电子作原电池的负极,则正极为碳棒,电池负极反应的电极方程式为Al-3e—+4OH—=AlO2—+2H2O。


 学而优暑期衔接南京大学出版社系列答案
学而优暑期衔接南京大学出版社系列答案 Happy holiday欢乐假期暑假作业广东人民出版社系列答案
Happy holiday欢乐假期暑假作业广东人民出版社系列答案 快乐暑假暑假能力自测中西书局系列答案
快乐暑假暑假能力自测中西书局系列答案科目:高中化学 来源: 题型:
【题目】1,4—环己二醇是一种重要的化工原料,它可通过下列路线合成:
![]()
(1)反应③、⑥的反应类型分别是____、____。
(2)有机物C按照系统命名,其名称是:____,D中的官能团名称是____。
(3)写出反应⑧的化学方程式为____。
(4)环己烷的一种同分异构体W,已知W分子中所有碳原子均在同一平面上,写出其结构简式____,W是否具有顺反异构____。(填”是“或”否“)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在浓度为0.01mol/L Mg(HCO3)2,0.02mol/LCaCl2的水溶液1L中,要同时除去Mg2+,Ca2+应选用的试剂是( )
A. NaHCO3 B. Na2CO3 C. Ca(OH)2 D. NaOH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】原电池发生的反应是可自发进行的氧化还原反应,CO/O2燃料电池以熔融状态的碳酸盐为电解质,下列说法正确的是 ( )
A、CO在正极通入
B、CO32— 在电池内部向正极移动
C、当有22.4LCO参加反应时电路中有2mol电子发生转移
D、该电池电解质在固态时,电池无法工作
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】水杨酸是合成阿司匹林的重要原料。水杨酸的学名邻羟基苯甲酸,结构简式为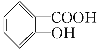 ,请回答下列问题:
,请回答下列问题:
(1)请写出水杨酸中具有的官能团名称________;
(2)能够区分水杨酸和苯酚的试剂_____ ___;
A.浓溴水 B.氢氧化钠溶液 C.氯化铁溶液 D.碳酸氢钠溶液
(3)水杨酸的另一种同分异构体的结构简式为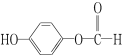 ,1 mol该有机物在适宜条件下与氢氧化钠经过一系列反应,最多能消耗氢氧化钠的物质的量为(填序号)________;
,1 mol该有机物在适宜条件下与氢氧化钠经过一系列反应,最多能消耗氢氧化钠的物质的量为(填序号)________;
A.1 mol B.2 mol C.3 mol D.4 mol
(4)已知有机物CH3COOH可以表示为:![]() ,在一定条件下,水杨酸与乙酸酐可合成阿司匹林,阿司匹林可表示为:
,在一定条件下,水杨酸与乙酸酐可合成阿司匹林,阿司匹林可表示为: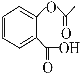 ,则阿司匹林分子式为________;
,则阿司匹林分子式为________;
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.海洋约占地球表面积的71%,所以地球上不缺水
B.海水淡化蒸馏法的成本最低
C.海水淡化的主要方法有蒸馏法、电渗析法和离子交换法等
D.以上说法都正确
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验是实现科学探究的重要途径。
(1)下列关于教材实验的叙述中正确的是
A.Cu片加入冷的浓硫酸中没有变化,说明Cu在浓硫酸中也会钝化
B.石油分馏时,控制温度,收集到的汽油为纯净物
C.用激光笔照射肥皂水,有丁达尔效应,说明肥皂水是胶体
D.淀粉水解液中加入银氨溶液,水浴加热后无银镜,说明淀粉未水解
E.鸡蛋白溶液中分别加入饱和硫酸铵、硫酸钾溶液时,都发生了盐析
(2)某兴趣小组设计出下图装置(气密性已检查),验证铜与稀硝酸反应的产物。
已知:FeSO4+NO=[Fe(NO)]SO4,该反应较缓慢,待生成一定量[Fe(NO)]2+时突显明显棕色。
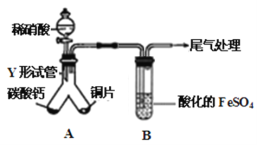
①实验开始时先将Y形试管向盛有碳酸钙的支管倾斜,缓慢滴入稀硝酸,该实验操作的目的是 。
②由分液漏斗向Y形试管右侧加入稀硝酸,反应的离子方程式是
。
③本实验A生成的气体中,若有NO2,B的实验现象为 ;若只有NO生成,B的实验现象是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式正确的是
A.氯化铝溶液中加入过量氨水:Al3++3NH3.H2O=Al(OH)3↓+3NH4+
B.碳酸钙和盐酸反应:CO32﹣+2H+=CO2↑+H2O
C.三氯化铁溶液与氢氧化钠溶液反应:FeCl3+3OH﹣=Fe(OH)3↓+3Cl﹣
D.铜加入稀硝酸中:Cu+4H++NO3﹣=Cu2++NO↑+2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氨气常用作致冷剂及制取铵盐和氮肥,是一种用途广泛的化工原料。
(1)下表是当反应器中按n(N2):n(H2)=1:3投料后,在200℃、400℃、600℃下,反应达到平衡时,混合物中NH3的物质的量分数随压强的变化曲线。
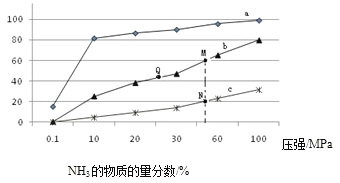
①曲线a对应的温度是 。
②关于工业合成氨的反应,下列叙述正确的是 (填字母)。
A. 及时分离出NH3可以提高H2的平衡转化率
B. 加催化剂能加快反应速率且提高H2的平衡转化率
C. 上图中M、N、Q点平衡常数K的大小关系是K(M)= K(Q) >K(N)
③ M点对应的H2转化率是 。
(2)工业制硫酸的尾气中含较多的SO2,为防止污染空气,回收利用SO2,工业上常用氨水吸收法处理尾气。
① 当氨水中所含氨的物质的量为3 mol ,吸收标准状况下44.8 L SO2时,溶液中的溶质为 。
② NH4HSO3溶液显酸性。用氨水吸收SO2,当吸收液显中性时,溶液中离子浓度关系正确的是 (填字母)。
a.c(NH4+) = 2c(SO32-) + c(HSO3-)
b.c(NH4+)> c(SO32-)> c(H+)= c(OH-)
c.c(NH4+)+ c(H+)= c(SO32-)+c(HSO3-)+c(OH-)
(3)氨气是一种富氢燃料,可以直接用于燃料电池,下图是供氨水式燃料电池工作原理:
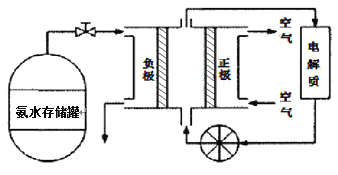
①氨气燃料电池的电解质溶液最好选择 (填“酸性”、“碱性”或“中性”)溶液。
②空气在进入电池装置前需要通过过滤器除去的气体是 。
③氨气燃料电池的反应是氨气与氧气生成一种常见的无毒气体和水,该电池正极的电极反应方是 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com