
【题目】绿矾别名青矾、皂荚矾等,是我国古代常用的药材,以硫铁矿[主要成分为二硫化亚铁(FeS2)]为原料制备绿矾晶体,工艺流程如下:
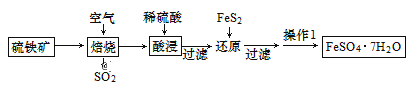
下列说法正确的是( )
A.焙烧过程中每生成1molSO2转移电子数为5NA
B.还原后所得滤液可用高锰酸钾检验Fe3+是否反应完全
C.为中和还原后滤液中过量的酸,可加入一定量FeCO3
D.操作1为蒸发结晶
【答案】C
【解析】
由制备流程可知,在空气中焙烧发生4FeS2+11O2 ![]() 2Fe2O3+8SO2,酸浸发生Fe2O3+6H+=2Fe3++3H2O,还原时发生FeS2+14Fe3++8H2O=2SO42-+15Fe2++16H+,过滤后,操作1为蒸发浓缩、冷却结晶、过滤、洗涤、干燥得到FeSO47H2O,以此来解答。
2Fe2O3+8SO2,酸浸发生Fe2O3+6H+=2Fe3++3H2O,还原时发生FeS2+14Fe3++8H2O=2SO42-+15Fe2++16H+,过滤后,操作1为蒸发浓缩、冷却结晶、过滤、洗涤、干燥得到FeSO47H2O,以此来解答。
A.焙烧发生4FeS2+11O2![]() 2Fe2O3+8SO2,生成8molSO2时转移44mol电子,则每生成1molSO2转移电子数为5.5NA,故A错误;
2Fe2O3+8SO2,生成8molSO2时转移44mol电子,则每生成1molSO2转移电子数为5.5NA,故A错误;
B.还原后所得滤液可用KSCN溶液检验Fe3+是否反应完全,亚铁离子可被高锰酸钾氧化,故B错误;
C.为中和还原后滤液中过量的酸,可加入一定量FeCO3,与硫酸反应生成硫酸亚铁,故C正确;
D.由溶液得到含结晶水的晶体,可知操作1为蒸发浓缩、冷却结晶、过滤、洗涤、干燥,故D错误;
故答案为C。


 字词句段篇系列答案
字词句段篇系列答案科目:高中化学 来源: 题型:
【题目】在一定条件下,金属单质X和非金属单质Y能够反应,生成化合物Z,Z能与水发生水解反应生成气体G和白色沉淀P(如下框图所示),已知气体G与空气之密度比约为1.17。请填空:
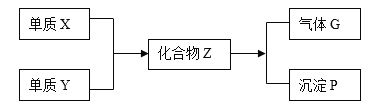
(1)组成单质X和Y的元素分别属第____________族和第___________族;
(2)Z与水发生水解反应方程式_____________________;
(3)每生成1mol的化合物Z,反应中转移_________________mol的电子。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,将NO2与SO2以体积比1:2置于密闭容器中发生反应:NO2(g)+ SO2(g)![]() SO3(g)+NO(g),下列能说明反应达到反应限度的是
SO3(g)+NO(g),下列能说明反应达到反应限度的是
A. 体系压强保持不变B. 混合气体颜色保持不变
C. SO3和NO的体积比保持不变D. 每消耗1 mol SO3的同时生成1 mol NO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】![]() 是一种有机烯醚,可以用烃A通过下列路线制得:
是一种有机烯醚,可以用烃A通过下列路线制得:
![]()
则下列说法正确的是( )
A.![]() 的分子式为C4H4O
的分子式为C4H4O
B.A的结构简式是CH2=CHCH2CH3
C.①②③的反应类型分别为卤代、水解、消去
D.A能使酸性高锰酸钾酸性溶液褪色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在标准状况下,在三个干燥的烧瓶内分别装有纯净的NH3,含一半空气的HCl气体, NO2 和O2的混合气体[V(NO2)∶V(O2) = 4∶1 ],然后分别作喷泉实验,三个烧瓶内所得溶液的物质的量浓度之比为
A. 2∶1∶2 B. 5∶5∶4 C. 1∶1∶1 D. 无法确定
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】维生素C是一种水溶性维生素,能够治疗坏血病并且具有酸性,所以俗称作抗坏血酸。具体合成路线如图所示:
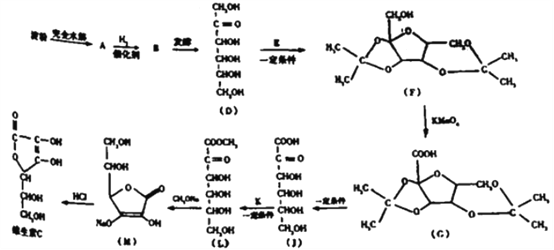
(1)下列说法不正确的是_____________
a.从结构上看维生素C不稳定,在受热、光照和长时间放置会变质
b.合成路线中的物质A、B、D都属于单质
c.用银镜反应不能判断淀粉水解是否完全
d.发酵的过程实际上是消去反应
e.图中的“一定条件”可能是“浓硫酸
(2)维生素C分子中含有的含氧官能团名称为:__________。
(3)核磁共振氢谱检验E只含有一种氢,则E的结构简式为_____,此步反应的目的是____。
(4)用新制氢氧化铜悬浊液检验A的实验现象为:_______,发生反应的化学方程式为:____。
(5)J的一种环状的同分异构体能发生水解反应和银镜反应,且含有6不同环境的氢,请写出该同分异构体可能的结构简式: ________(任写1种).
(6)参照上述合成路线设计以下合成路线:_________________
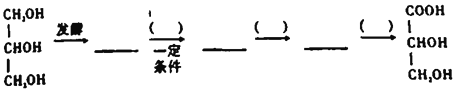
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E是原子序数依次增大的五种短周期元素。A原子的电子层数与它的核外电子总数相同,A与C、B与D分别为同主族,B和C的最外层电子数之和与E的最外层电子数相同。A与E形成的化合物化学式为AE,其分子中含18个电子。请回答下列问题:
(1)A元素单质的化学式为__________________。
(2)由A、B、C三种元素形成的化合物的电子式为___________,这种化合物形成的晶体中所含的化学键类型有______________。
(3)A、B、D三种元素形成的一种化合物和A、B形成的一种化合物能发生氧化还原反应,反应的化学方程式为_____________________________________________。
(4)B、C、E三种元素形成一种盐,此盐中三种原子个数比为1∶1∶1,在25℃时,将该盐溶于水,测得溶液pH>7,理由是___________________________(用离子方程式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】回答下列问题:
(1)在25℃、101kPa时,1.00g C6H6(l)燃烧生成CO2和H2O(l)时,放出41.8kJ的热量,表示C6H6(l)燃烧热的热化学方程式为___。
(2)1.00L 1.00mol/LH2SO4溶液与2.00L 1.00mol/L NaOH溶液完全反应,放出114.6kJ的热量,表示其中和热的热化学方程式为___。
(3)已知反应CH3-CH3→CH2=CH2(g)+H2(g),有关化学键的键能如下:
化学键 | C-H | C=C | C-C | H-H |
键能E/kJ/mol | 414.4 | 615.3 | 347.4 | 435.3 |
通过计算得出该反应的反应热为_______________。
(4)已知2.0g燃料肼(N2H4)气体完全燃烧生成N2和H2O(g)时,放出33.4kJ的热量,则该反应的热化学方程式为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】诺贝尔奖获得者屠呦呦带领团队发现了青蒿素,为中医药科技创新和人类健康事业作出巨大贡献。我国化学家在确认青蒿素分子结构之后实现了青蒿素的全合成。根据信息(部分条件和步骤已省略)回答下列问题:
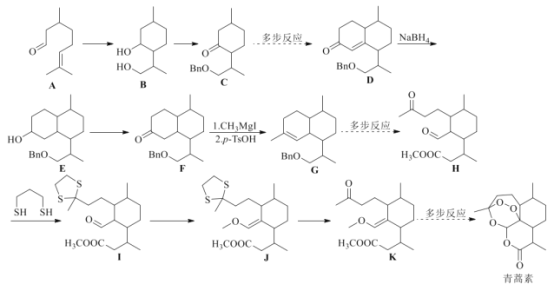
已知:![]() ,按要求回答下列问题:
,按要求回答下列问题:
(1)B的分子式为________________,所含官能团名称为________________________。![]() 的反应类型为________________。
的反应类型为________________。
(2)A的同系物中含碳原子数目最少的物质的结构简式为________________。A的同分异构体X含有醛基和六元碳环,且环上只有一个支链,满足上述条件的X有________种,其中核磁共振氢谱峰数最少的物质的结构简式为________________。
(3)写出A与银氨溶液反应的化学方程式________________________________。
(4)通过![]() 的反应,分子中引入了硫醚基团,而
的反应,分子中引入了硫醚基团,而![]()
![]() 的反应,分子中硫醚基团又被脱去,这样做的目的是________________。
的反应,分子中硫醚基团又被脱去,这样做的目的是________________。
(5)根据青蒿素所含官能团,推测其可能具有的性质________。
a.具有氧化性 b.可发生水解反应 c.易溶于水
(6)参照上述合成路线,写出以![]() 为主要原料,经四步反应制备
为主要原料,经四步反应制备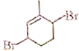 的流程。_____________
的流程。_____________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com