
| 50 |
| 29 |
| 50 |
| 29 |
| ||
| 50 |
| 29 |
| 50 |
| 29 |
| 56x+16y |
| 1g |
| 100y | ||
|
| x |
| y |
| 3 |
| 4 |


 心算口算巧算一课一练系列答案
心算口算巧算一课一练系列答案科目:高中化学 来源: 题型:
| 物质及其杂质 | 检验 | 除杂 |
| A.Cl2(HCl) | 湿润的淀粉KI试纸 | 饱和食盐水 |
| B.NaHCO3溶液(Na2CO3) | Ca(OH)2溶液 | 过量CO2 |
| C.CO2(HCl) | AgNO3溶液(含稀硝酸) | 饱和Na2CO3溶液 |
| D.FeCl3溶液(FeCl2) | 酸性KMnO4溶液 | Cl2 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
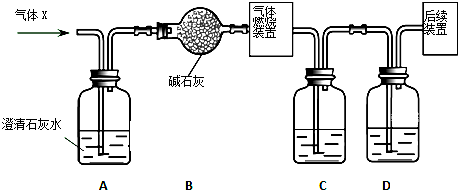
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
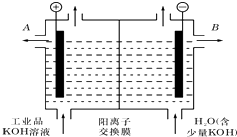 铝和氢氧化钾都是重要的工业产品.请回答:
铝和氢氧化钾都是重要的工业产品.请回答:查看答案和解析>>
科目:高中化学 来源: 题型:
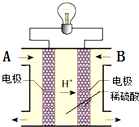 为解决环境、能源等问题,科学家正研究将CO2转化为CH3OH技术. 该转化反应为CO2+3H2=CH3OH+H2O.
为解决环境、能源等问题,科学家正研究将CO2转化为CH3OH技术. 该转化反应为CO2+3H2=CH3OH+H2O.查看答案和解析>>
科目:高中化学 来源: 题型:
| A、1 mol苯乙烯中含碳碳双键数为4NA |
| B、30 g 甲醛和醋酸的混合物中含碳原子数目为NA |
| C、标准状况下,22.4 L空气含单质分子数目为NA |
| D、0.5 mol Na2O2溶解于1 L水中得Na+的物质的量浓度为1 mol?L-1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com