
【题目】在某恒温密闭容器中,投入一定量的A发生可逆反应:A(s)![]() B(g)+C(g),△H=-Q kJ/mol(Q>O)。一段时间后反应达到平衡,然后缩小容器体积,重新达到平衡。下列分析不正确的是
B(g)+C(g),△H=-Q kJ/mol(Q>O)。一段时间后反应达到平衡,然后缩小容器体积,重新达到平衡。下列分析不正确的是
A. 两次平衡时,C(g)的浓度相等
B. 平衡时,单位时间内n(B)生成:n(C)消耗=1:1
C. 若再向平衡体系中加入少量A,平衡不移动
D. 若开始时向容器中加入1 mol B和1 mol C,则达到平衡时吸收QkJ热量
【答案】D
【解析】A,温度不变时,加压,化学平衡向气体体积减小的方向移动,但是化学平衡常数不变,因为K=c(B)c(C)不变,所以B和C的浓度是不变的,A正确。B,化学平衡状态的正反应速率和逆反应速率是相等的,表现在具体物质上就是在同一容器中,单位时间内反应物和生成物的物质的量的变化量与它们的化学计量数成正比,所以单位时间内n(B)生成:n(C)消耗=1:1表示的就是v((正)=v(逆),B正确 。C,向平衡体系中加入少量A并不能改变固体反应物A的浓度,所以平衡不移动,C正确 。D,根据A(s)![]() B(g)+C(g),△H=-Q kJ/mol(Q>O)可知,1molA完全分解生成1 mol B和1 mol C可放出QkJ热量,1 mol B和1 mol C完全化合为1molA可吸收QkJ热量。若开始时向容器中加入1 mol B和1 mol C,由于该反应为可逆反应,B和C不能完全化合为A,则达到平衡时吸收的热量小于QkJ ,所以D不正确。
B(g)+C(g),△H=-Q kJ/mol(Q>O)可知,1molA完全分解生成1 mol B和1 mol C可放出QkJ热量,1 mol B和1 mol C完全化合为1molA可吸收QkJ热量。若开始时向容器中加入1 mol B和1 mol C,由于该反应为可逆反应,B和C不能完全化合为A,则达到平衡时吸收的热量小于QkJ ,所以D不正确。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】U常见化合价有+4和+6。硝酸铀酰[UO2(NO3)2]加热可发生如下分解:
[UO2(NO3)2]―→UxOy+NO2↑+O2↑(未配平)
将气体产物收集于试管中并倒扣于盛水的水槽中,气体全部被吸收,水充满试管。则生成的铀的氧化物化学式是( )
A.UO2 B.2UO2·UO3
C.UO3 D.UO2·2UO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】取浓度均为0.1mol/L的NaA和NaB两种盐溶液各1L,分别通入0.02molCO2,发生反应:NaA+CO2+H2O=HA+NaHCO3、2NaB+CO2+H2O=2HB+Na2CO3。将浓度均为0.1mol/L、体积均为1L的HA溶液和HB溶液分别加水稀释至体积为VL,溶液pH的变化曲线如图所示,则下列说法正确的是

A.HA是强酸,HB是弱酸
B.X是HB,Y是HA
C.常温下,pH相等的NaA溶液与NaB溶液的物质的量浓度:c(NaA)<c(NaB)
D.NaA与NaB的混合溶液中:c(Na+)+c(H+)=c(A-)+c(B-)+c(HA)+c(HB)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在密闭容器里,A与B反应生成C,其反应速率分别用v(A)、v(B)、v(C)表示,已知3v(B)=2v(A)、2v(C)=3v(B),则此反应可表示为
A. 2A+3B = 2C B. A+3B = 2C C. 3A+2B = 3C D. A+B = C
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“绿色化学”是当今社会提出的一个新概念。在该工艺中,理想状态是反应中原子全部转化为目标产物,即原子利用率为100%。利用以下各种化学反应类型的合成过程最符合绿色化学的是
A. 取代反应 B. 水解反应 C. 加聚反应 D. 酯化反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对下列反应:3Fe3O4+28HNO3=9Fe(NO3)x+NO↑+14H2O判断合理的是
A.Fe(NO3)x中的x为3
B.标准状况下产生4.48LNO,就有0.5 mol电子转移
C.稀HNO3在反应中只作氧化剂
D.磁性氧化铁中的铁元素全部被氧化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】四氧化三铁(Fe3O4)磁性纳米颗粒稳定、容易生产且用途广泛,是临床诊断、生物技术和环境化学等多个领域潜在应用的有力工具。水热法制备Fe3O4纳米颗粒的反应是
3Fe2+2S2O![]() +O2+xOH-
+O2+xOH-![]() Fe3O4↓+S4O
Fe3O4↓+S4O![]() +2H2O。
+2H2O。
请回答下列问题:
(1)水热法制备Fe3O4纳米颗粒的反应中,还原剂是__________________,S2O![]() 中S的化合价为________________.
中S的化合价为________________.
(2)反应的化学方程式中![]() =____________.
=____________.
(3)每生成 1mol Fe3O4,反应转移的电子为_________mol,被Fe2+还原的O2的物质的量为________mol.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】1L某混合溶液中,溶质X、Y浓度都为0.1mol/L,向混合溶液中滴加某溶液Z(0.lmol/L氢氧化钠或硫酸溶液),所得沉淀的物质的量如图所示,则X、Y、Z分别是( )
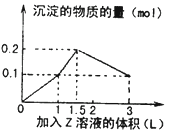
A.氯化铝、氯化铁、氢氧化钠 B.氯化铝、氯化镁、氢氧化钠
C.偏铝酸钠、氢氧化钡、硫酸 D.偏铝酸钠、氯化钡、硫酸
查看答案和解析>>
科目:高中化学 来源: 题型:
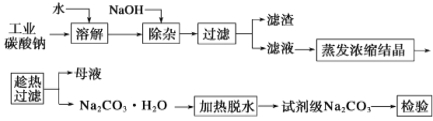
【题目】碳酸钠是造纸、玻璃、纺织、制革等行业的重要原料。工业碳酸钠(纯度约98%)中含有Ca2+、Mg2+、Fe3+、Cl-和SO42-等杂质,提纯工艺流程如下:
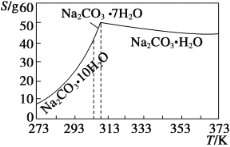
已知碳酸钠的溶解度(S)随温度变化的曲线如下图所示:
回答下列问题:
(1)滤渣的主要成分为_____________________________。
(2)“趁热过滤”的原因是_________________________。
(3)若在实验室进行“趁热过滤”,可采取的措施是________(写出一种)。
(4)已知:Na2CO3·10H2O (s)===Na2CO3(s)+10H2O(g) ΔH1= +532.36 kJ·mol-1
Na2CO3·10H2O(s)===Na2CO3·H2O(s)+9H2O(g) ΔH2= +473.63 kJ·mol-1
写出Na2CO3·H2O脱水反应的热化学方程式____________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com