
【题目】环境中常见的重金属污染物有汞、铅、锰、铬、镉。处理工业废水中含有的![]() 和
和![]() 常用的方法是还原沉淀法,该法的工艺流程为
常用的方法是还原沉淀法,该法的工艺流程为![]()
![]()
![]()
![]() Cr3+
Cr3+![]() Cr(OH)3。
Cr(OH)3。
其中第①步存在平衡:2![]() (黄色)+2H+
(黄色)+2H+![]()
![]() (橙色)+H2O。
(橙色)+H2O。
(1)写出第①步反应的平衡常数表达式:_________________________________。
(2)关于第①步反应,下列说法正确的是________(填序号)。
A.通过测定溶液的pH可以判断反应是否已达到平衡状态
B.该反应为氧化还原反应
C.在强酸性环境下,溶液的颜色为橙色
(3)第②步反应中,还原0.1 mol![]() ,需要________mol FeSO4·7H2O。
,需要________mol FeSO4·7H2O。
(4)第③步反应除生成Cr(OH)3沉淀外,还可能生成的沉淀为________。
(5)在溶液中存在以下沉淀溶解平衡:Cr(OH)3(s)![]() Cr3+(aq)+3OH-(aq)。常温下,Cr(OH)3的溶度积常数Ksp=10-32,当溶液中Cr3+的浓度降至10-5mol·L-1,认为Cr3+已经完全沉淀。现将第③步反应后溶液的pH调至4,请通过计算说明Cr3+是否沉淀完全(请写出计算过程)。____________
Cr3+(aq)+3OH-(aq)。常温下,Cr(OH)3的溶度积常数Ksp=10-32,当溶液中Cr3+的浓度降至10-5mol·L-1,认为Cr3+已经完全沉淀。现将第③步反应后溶液的pH调至4,请通过计算说明Cr3+是否沉淀完全(请写出计算过程)。____________
【答案】K=![]() AC0.6Fe(OH)3当pH调至4时,c(OH-)=10-10mol·L-1,c(Cr3+)=10-32/c3(OH-)=10-2mol·L-1>10-5mol·L-1,因此Cr3+没有沉淀完全
AC0.6Fe(OH)3当pH调至4时,c(OH-)=10-10mol·L-1,c(Cr3+)=10-32/c3(OH-)=10-2mol·L-1>10-5mol·L-1,因此Cr3+没有沉淀完全
【解析】
(1)因H2O是纯液态物质,其浓度视为常数,故第①步反应的平衡常数表达式为K=![]() ;(2)利用反应①可知,反应正向进行时,溶液pH增大,故pH不变时说明反应达到平衡,A项正确;CrO
;(2)利用反应①可知,反应正向进行时,溶液pH增大,故pH不变时说明反应达到平衡,A项正确;CrO![]() 和Cr2O
和Cr2O![]() 中Cr均为+6价,该反应不是氧化还原反应,B项错误;在酸性环境中,溶液中c(Cr2O
中Cr均为+6价,该反应不是氧化还原反应,B项错误;在酸性环境中,溶液中c(Cr2O![]() )较大,溶液呈橙色,C项正确,故答案为:AC;(3)在第②步反应中Cr2O
)较大,溶液呈橙色,C项正确,故答案为:AC;(3)在第②步反应中Cr2O![]() 被还原为Cr3+,0.1 mol Cr2O
被还原为Cr3+,0.1 mol Cr2O![]() 被还原时转移电子的物质的量为0.1 mol×2×(6-3)=0.6 mol,而还原剂Fe2+被氧化为Fe3+,故需要消耗0.6 mol FeSO4·7H2O,故答案为:0.6;(4)在第②步反应中Fe2+被氧化为Fe3+,故第③步还有Fe(OH)3生成,故答案为:Fe(OH)3;(5)当pH调至4时,[OH-]=10-10 mol·L-1,[Cr3+]=10-32/[OH-]3 =10-2 mol·L-1>10-5 mol·L-1,因此Cr3+没有沉淀完全。
被还原时转移电子的物质的量为0.1 mol×2×(6-3)=0.6 mol,而还原剂Fe2+被氧化为Fe3+,故需要消耗0.6 mol FeSO4·7H2O,故答案为:0.6;(4)在第②步反应中Fe2+被氧化为Fe3+,故第③步还有Fe(OH)3生成,故答案为:Fe(OH)3;(5)当pH调至4时,[OH-]=10-10 mol·L-1,[Cr3+]=10-32/[OH-]3 =10-2 mol·L-1>10-5 mol·L-1,因此Cr3+没有沉淀完全。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】下列各组物质:①O2和O3 ②H2、D2、T2 ③![]() 和
和![]() ④CH3CH2CH2CH3和
④CH3CH2CH2CH3和![]()
![]() 乙烷和丁烷
乙烷和丁烷
请用序号回答下列问题:
互为同系物的是______,互为同分异构体的是______,互为同位素的是______,互为同素异形体的是______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定条件下,对于密闭容器中进行的可逆反应A(g)+3B(g) ![]() 2C(g),下列说 法中,能说明这一反应已经达到化学平衡状态的是
2C(g),下列说 法中,能说明这一反应已经达到化学平衡状态的是
A. 生成C的速率是生成A的速率的两倍
B. A、B、C的浓度相等
C. 单位时间生成 n mol A,同时生成 3n mol B
D. A、B、C的分子数之比为 1∶3∶2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下将NaOH溶液添加到己二酸(H2X)溶液中,混合溶液的pH与离子浓度变化的关系如图所示。下列叙述错误的是
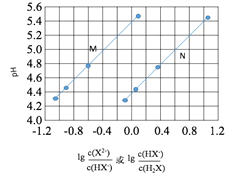
A. Ka2(H2X)的数量级为10-6
B. 曲线N表示pH与 的变化关系
的变化关系
C. NaHX溶液中c(H+)>c(OH-)
D. 当混合溶液呈中性时,c(Na+)>c(HX-)>c(X2-)>c(H+)=c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示的电解池Ⅰ和Ⅱ中,a、b、c和d均为Pt电极。电解过程中,电极b和d上
没有气体逸出,但质量均增大,且增重b>d。符合上述实验结果的盐溶液是

选项 | X | Y |
A | MgSO4 | CuSO4 |
B | AgNO3 | Pb(NO3)2 |
C | FeSO4 | Al2 (SO4)3 |
D | CuSO4 | AgNO3 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是元素周期表的一部分,下列叙述不正确的是
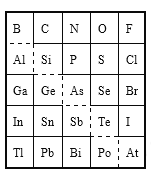
A. Sn的最高正价为+4
B. Br的最高价氧化物对应水化物的化学式为HBrO3
C. 酸性强弱:H3AsO4<H2SeO4
D. 原子半径比较:N<Si
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在AlCl3和MgCl2的混合液中滴加NaOH溶液,生成沉淀的量与滴入NaOH溶液的体积关系如下图所示,则原溶液中AlCl3和MgCl2的物质的量之比为( )
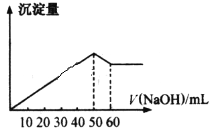
A. 1:2B. 1:1C. 2:1D. 3:1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据下列实验:
①向Fe2(SO4)3和CuSO4的混合液中加入过量铁粉,充分反应,有红色固体析出,过滤。
②取①中滤液,向其中滴加KSCN溶液,观察现象。
判断下列说法正确的是
A. 氧化性Cu2+>Fe3+
B. ①中所得固体只含铜
C. ①中滤液含有Cu2+和Fe2+
D. ②中不会观察到溶液变红
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】完成下列各题:
(1)烃A的结构简式为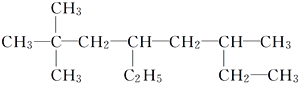 。用系统命名法命名烃A:__________________________________________________。
。用系统命名法命名烃A:__________________________________________________。
(2)某烃的分子式为C5H12,核磁共振氢谱图中显示三个峰,则该烃的一氯代物有________种,该烃的结构简式为________________。
(3)麻黄素又称黄碱,是我国特定的中药材麻黄中所含有的一种生物碱。经科学家研究发现其结构如下: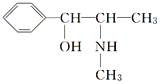 。下列各物质:
。下列各物质:
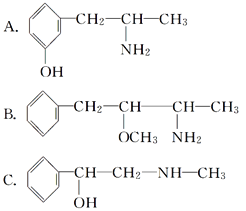
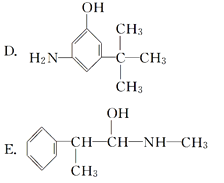
与麻黄素互为同分异构体的是________(填字母,下同),互为同系物的是________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com