
ЁОЬтФПЁПЯТБэЪЧВЛЭЌЮТЖШЯТЫЎЕФРызгЛ§ГЃЪ§ЃК
ЮТЖШ/Ёц | 25ЁуC | 99ЁуC |
ЫЎЕФРызгЛ§ГЃЪ§ | 1ЁСl0-14 | 1ЁСl0-12 |
ЪдЛиД№вдЯТЮЪЬтЃЈЩшЛьКЯКѓШмвКЕФЬхЛ§ЮЊдСНШмвКЬхЛ§жЎКЭЃЉЃК
ЃЈ1ЃЉ25ЁцЪБЃЌНЋpH=11ЕФПСадФЦШмвКV1LгыpH=1ЕФЯЁСђЫсV2LЛьКЯЃЌЫљЕУЛьКЯШмвКЕФpH=2ЃЌдђV1ЃКV2 =___________ЁЃДЫШмвКжаИїжжРызгЕФХЈЖШгЩДѓЕНаЁЕФЫГађЪЧ_________________ЁЃ
ЃЈ2ЃЉ99ЁцЪБЃЌНЋpH=2ЕФСђЫсКЭpH=10ЕФЧтбѕЛЏФЦШмвКЕШЬхЛ§ЛьКЯЃЌдђЛьКЯШмвКжаЕФcЃЈH+ЃЉ=__molЁЄL-1ЁЃ
ЃЈ3ЃЉМйЩшH2AЪЧЧПЫсЃЌЕЋГЃЮТЯТ0.1molЁЄL-1H2AЕФШмвКжаc ЃЈH+ЃЉ=0.11mol L-1ЃЌдђNaHAШмвКГЪ___________адЃЈЬюЁАЫсЁБЁЂЁАМюЁБЛђЁАжаЁБЃЉЃЌ0. lmolЁЄL-1ЕФNaHAШмвКЕФcЃЈH+ЃЉ________0. 0lmol L-1 ЃЈЬюЁА>ЁБЁЂЁА<ЁБЛђЁА=ЁБЃЉЃЛH2AШмвКгыNa2AШмвКЗДгІЕФРызгЗНГЬЪНЮЊ_____________________ЁЃ
ЁОД№АИЁП 90ЃК11 cЃЈH+ЃЉ>cЃЈSO42-ЃЉ>cЃЈNa+ЃЉ>cЃЈOH-ЃЉ 10-6 Ыс > H++A2-=HA-
ЁОНтЮіЁПЪдЬтЗжЮіЃКБОЬтПМВщpHЕФМЦЫуЃЌШмвКжаСЃзгХЈЖШЕФДѓаЁЙиЯЕЃЌЭтНчЬѕМўЖдЕчРыЦНКтЕФгАЯьвдМАРызгЗНГЬЪНЕФЪщаДЁЃ
ЃЈ1ЃЉЛьКЯКѓШмвКpH=2ЃЌNaOHКЭЯЁСђЫсЗДгІКѓСђЫсЙ§СПЃЌ1![]() 10-2mol/L=ЃЈ1
10-2mol/L=ЃЈ1![]() 10-1mol/LV2L-1
10-1mol/LV2L-1![]() 10-3mol/LV1LЃЉ
10-3mol/LV1LЃЉ![]() ЃЈV1+V2ЃЉLЃЌV1ЃКV2 =90:11ЁЃдNaOHШмвКжаcЃЈNa+ЃЉ=1
ЃЈV1+V2ЃЉLЃЌV1ЃКV2 =90:11ЁЃдNaOHШмвКжаcЃЈNa+ЃЉ=1![]() 10-3mol/LЃЌдЯЁСђЫсжаcЃЈSO42-ЃЉ=0.05mol/LЃЛЛьКЯКѓcЃЈNa+ЃЉ=1
10-3mol/LЃЌдЯЁСђЫсжаcЃЈSO42-ЃЉ=0.05mol/LЃЛЛьКЯКѓcЃЈNa+ЃЉ=1![]() 10-3mol/LV1L
10-3mol/LV1L![]() ЃЈV1+V2ЃЉL=8.91
ЃЈV1+V2ЃЉL=8.91![]() 10-4mol/LЃЌcЃЈSO42-ЃЉ=0.05mol/LV2L
10-4mol/LЃЌcЃЈSO42-ЃЉ=0.05mol/LV2L![]() ЃЈV1+V2ЃЉL=5.45
ЃЈV1+V2ЃЉL=5.45![]() 10-3mol/LЃЌДЫЪБИїжжРызгХЈЖШгЩДѓЕНаЁЕФЫГађЮЊcЃЈH+ЃЉ>cЃЈSO42-ЃЉ>cЃЈNa+ЃЉ>cЃЈOH-ЃЉЁЃ
10-3mol/LЃЌДЫЪБИїжжРызгХЈЖШгЩДѓЕНаЁЕФЫГађЮЊcЃЈH+ЃЉ>cЃЈSO42-ЃЉ>cЃЈNa+ЃЉ>cЃЈOH-ЃЉЁЃ
ЃЈ2ЃЉ99ЁцЃЌpH=2ЕФСђЫсШмвКжаcЃЈH+ЃЉ=1![]() 10-2mol/LЃЌpH=10ЕФNaOHШмвКжаcЃЈOH-ЃЉ=1
10-2mol/LЃЌpH=10ЕФNaOHШмвКжаcЃЈOH-ЃЉ=1![]() 10-12
10-12![]() ЃЈ1
ЃЈ1![]() 10-10ЃЉ=1
10-10ЃЉ=1![]() 10-2mol/LЃЌСНепЕШЬхЛ§ЛьКЯЧЁКУЭъШЋЗДгІЃЌШмвКГЪжаадЃЌ99ЁцжаадШмвКжаcЃЈH+ЃЉ=1
10-2mol/LЃЌСНепЕШЬхЛ§ЛьКЯЧЁКУЭъШЋЗДгІЃЌШмвКГЪжаадЃЌ99ЁцжаадШмвКжаcЃЈH+ЃЉ=1![]() 10-6mol/LЃЌЛьКЯШмвКжаcЃЈH+ЃЉ=1
10-6mol/LЃЌЛьКЯШмвКжаcЃЈH+ЃЉ=1![]() 10-6mol/LЁЃ
10-6mol/LЁЃ
ЃЈ3ЃЉМйЩшH2AЪЧЧПЫсЃЌЕЋГЃЮТЯТ0.1molЁЄL-1H2AЕФШмвКжаc ЃЈH+ЃЉ=0.11mol L-1ЃЌЫЕУїH2AдкЫЎШмвКжаЕФЕчРыЗНГЬЪНЮЊЃКH2A=H++HA-ЁЂHA-![]() H++A2-ЃЌЕквЛВНЕчРыГіcЃЈH+ЃЉ=0.1mol/LЃЌЕкЖўВНЕчРыГіЕФcЃЈH+ЃЉ=0.01mol/LЁЃNaHAШмвКжаДцдкЕФЕчРыЗНГЬЪНЮЊЃКNaHA=Na++HA-ЁЂHA-
H++A2-ЃЌЕквЛВНЕчРыГіcЃЈH+ЃЉ=0.1mol/LЃЌЕкЖўВНЕчРыГіЕФcЃЈH+ЃЉ=0.01mol/LЁЃNaHAШмвКжаДцдкЕФЕчРыЗНГЬЪНЮЊЃКNaHA=Na++HA-ЁЂHA-![]() H++A2-ЃЌNaHAШмвКГЪЫсадЃЛ0. lmolЁЄL-1ЕФNaHAШмвКжаcЃЈH+ЃЉ
H++A2-ЃЌNaHAШмвКГЪЫсадЃЛ0. lmolЁЄL-1ЕФNaHAШмвКжаcЃЈH+ЃЉ![]() 0. 0lmol L-1ЃЌдвђЪЧЃКгы0.1mol/LH2AШмвКБШЃЌH2AШмвКжаH2AЕквЛВНЕчРыГіЕФH+ЖдHA-ЕФЕчРыЦ№вжжЦзїгУЁЃгЩгкH2AЪЧЧПЫсЃЌаДРызгЗНГЬЪНгІИФаДГЩH+КЭHA-ЃЌдђH2AШмвКгыNa2AШмвКЗДгІЕФРызгЗНГЬЪНЮЊЃКH++A2-=HA-ЁЃ
0. 0lmol L-1ЃЌдвђЪЧЃКгы0.1mol/LH2AШмвКБШЃЌH2AШмвКжаH2AЕквЛВНЕчРыГіЕФH+ЖдHA-ЕФЕчРыЦ№вжжЦзїгУЁЃгЩгкH2AЪЧЧПЫсЃЌаДРызгЗНГЬЪНгІИФаДГЩH+КЭHA-ЃЌдђH2AШмвКгыNa2AШмвКЗДгІЕФРызгЗНГЬЪНЮЊЃКH++A2-=HA-ЁЃ


 аЁбЇНЬВФЭъШЋНтЖСЯЕСаД№АИ
аЁбЇНЬВФЭъШЋНтЖСЯЕСаД№АИ
| ФъМЖ | ИпжаПЮГЬ | ФъМЖ | ГѕжаПЮГЬ |
| ИпвЛ | ИпвЛУтЗбПЮГЬЭЦМіЃЁ | ГѕвЛ | ГѕвЛУтЗбПЮГЬЭЦМіЃЁ |
| ИпЖў | ИпЖўУтЗбПЮГЬЭЦМіЃЁ | ГѕЖў | ГѕЖўУтЗбПЮГЬЭЦМіЃЁ |
| ИпШ§ | ИпШ§УтЗбПЮГЬЭЦМіЃЁ | ГѕШ§ | ГѕШ§УтЗбПЮГЬЭЦМіЃЁ |
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПФГвЛЗДгІЬхЯЕгаЗДгІЮяКЭЩњГЩЮяЙВЮхжжЮяжЪЃКO2ЁЂH2CrO4ЁЂCrЃЈOHЃЉ3ЁЂH2OЁЂH2O2вбжЊИУЗДгІжаH2O2жЛЗЂЩњШчЯТЙ§ГЬЃКH2O2ЁњO2
ЃЈ1ЃЉИУЗДгІжаЕФбѕЛЏМСЪЧ ЃЌ
ЃЈ2ЃЉИУЗДгІжаЃЌЗЂЩњЛЙдЗДгІЕФЙ§ГЬЪЧЁњ ЃЌ
ЃЈ3ЃЉаДГіИУЗДгІЕФЛЏбЇЗНГЬЪНЃЌВЂгУЫЋЯпЧХБъГіЕчзгзЊвЦЕФЗНЯђКЭЪ§ФП ЃЎ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁП0.10mol/LЕФNaAlO2ШмвКжаЃЌРызгХЈЖШзюаЁЕФЪЧ(ЁЁЁЁ)
A.Na+B.H+C.AlO2ЉD.OHЉ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПНЋШмвКжаЕФMg2+ЁЂAl3+ЗжРыЃЌПЩбЁгУЕФЪдМСЪЧ(ЁЁЁЁ)
A.АБЫЎB.NaOHC.NaOHКЭбЮЫсD.K2CO3ШмвК
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПКЯН№ЪЧживЊЕФН№ЪєВФСЯЃЎ
ЃЈ1ЃЉЯТСаЮяЦЗЫљЪЙгУЕФжївЊВФСЯЪєгкКЯН№ЕФЪЧЃЈЬюзжФИађКХЃЌЯТЭЌЃЉЃЎ
A.ЧрЛЈДЩЦП
B.Я№НКГфЦјЭЇ
C.ВЛатИжЙј
ЃЈ2ЃЉЩњЬњЪЧГЃгУЕФКЯН№ЃЌЩњЬњЪєгкЃЈЬюЁАДПОЛЮяЁБЛђЁАЛьКЯЮяЁБЃЉЃЎ
ЃЈ3ЃЉЛЦЭЪЧЭаПКЯН№ЃЌНЋДПЭЦЌКЭЛЦЭЦЌЛЅЯрПЬЛЃЈШчЭМЫљЪОЃЉЃЌДПЭЦЌЩЯСєЯТУїЯдЕФЛЎКлЃЌЫЕУї ЃЎ
ЃЈ4ЃЉЛЦЭдќжадМКЌZn7%ЁЂZnO31%ЁЂCu50%ЁЂCuO5%ЃЌЦфгрЮЊдгжЪЃЎДІРэЛЦЭдќПЩЕУЕНСђЫсаПЃЌЦфжївЊСїГЬШчЯТЃЈдгжЪВЛШмгкЫЎЁЂВЛВЮгыЗДгІЃЉЃК 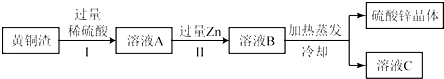
вбжЊЃКZnO+H2SO4ЈTZnSO4+H2OЃЛ CuO+H2SO4ЈTCuSO4+H2O
ЂйЂђжаЗДгІЕФЛЏбЇЗНГЬЪНЮЊЃЛ
ЂкЯТСаЫЕЗЈе§ШЗЕФЪЧ ЃЎ
aЃЎЂёЁЂЂђжаЕФВйзїОљАќКЌЙ§ТЫ bЃЎШмвКAжаZnSO4ЕФжЪСПДѓгкCuSO4
cЃЎШмвКA ЕФжЪСПаЁгкШмвКB dЃЎШмвКCжаШмжЪЕФжЪСПЗжЪ§аЁгкШмвКBЃЎ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПЯТСаЮяжЪВЛЪєгкЬьШЛИпЗжзгЛЏКЯЮяЕФЪЧ
A. ЯЫЮЌЫи B. ЕААзжЪ
C. гЭжЌ D. ЕэЗл
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПЫЎжаШмбѕСПЃЈDOЃЉЪЧКтСПЫЎЬхздОЛФмСІЕФвЛИіжИБъЃЌЭЈГЃгУУПЩ§ЫЎжаШмНтбѕЗжзгЕФжЪСПБэЪОЃЌЕЅЮЛmgЁЄL-1ЁЃЮвЙњЁЖЕиБэЫЎЛЗОГжЪСПБъзМЁЗЙцЖЈЃЌЩњЛювћгУЫЎдДЕФDOВЛФмЕЭгк5 mgЁЄL-1ЁЃЫЎжаШмНтбѕЕФВтЖЈВНжшШчЯТЃК
ЃЈ1ЃЉЯђвЛЖЈСПЫЎбљжаМгШыЪЪСПMnSO4КЭМюадKIШмвКЃЌЩњГЩMnOЃЈOHЃЉ2ГСЕэЃЌУмЗтОВжУЃЛ
ЃЈ2ЃЉМгШыЪЪСПЯЁH2SO4ЃЌНСАшЃЌЕШMnOЃЈOHЃЉ2гыI-ЭъШЋЗДгІЩњГЩMn2+КЭI2КѓЃЛ
ЃЈ3ЃЉгУNa2S2O3БъзМШмвКЕЮЖЈжСжеЕуЁЃ
ВтЖЈЙ§ГЬжаЮяжЪЕФзЊЛЏЙиЯЕШчЯТЃК
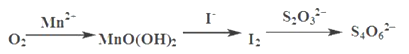
вбжЊЃКMnOЃЈOHЃЉ2+2I-+4H+ =Mn2++I2+3H2O 2S2O32- +I2= S4O62-+2I-
ЂйМгШыЯЁСђЫсКѓНСАшЕФзїгУЪЧ__________ЃЛNa2S2O3БъзМШмвКгІзАдк______________ЕЮЖЈЙмжаЃЈЬюЫсЪНЛђМюЪНЃЉЁЃ
ЂкЕЮЖЈЙ§ГЬжавд_____________ЮЊжИЪОМСЃЛДяЕНЕЮЖЈжеЕуЕФБъжОЮЊ____________________ЁЃ
ЂлаДГіO2НЋMn2+бѕЛЏГЩMnOЃЈOHЃЉ2ЕФРызгЗНГЬЪН____________________ЃЛ
ЂмШєМгШыЕФЯЁH2SO4ШмвКЗДгІКѓЃЌШєШмвКpHЙ§ЕЭЃЌЕЮЖЈЪБЛсВњЩњУїЯдЕФЮѓВюЁЃаДГіВњЩњЮѓВюЕФвЛИідвђЃЈгУРызгЗНГЬЪНБэЪОЃЉ__________________ЁЃ
ЂнЯТСаВйзїЪЙВтЕУЫЎбљжаШмбѕСПЃЈDOЃЉБШЪЕМЪжЕЦЋИпЕФЪЧ__________________ЁЃ
A.ЕкЃЈ1ЃЉВНВйзїОВжУЪБУЛгаУмЗт B.зАNa2S2O3БъзМШмвКЕФЕЮЖЈЙмУЛгаШѓЯД
C.ЕЮЖЈЧАзЖаЮЦПЯДОЛКѓУЛгаИЩдя D.ЕЮЖЈЧАЖСЪ§е§ШЗЃЌЕЮЖЈКѓИЉЪгЖСЪ§
ЂоШЁМгЙ§вЛЖЈСПCaO2ЁЄ8H2OЕФГиЬСЫЎбљl00.00mLЃЌАДЩЯЪіЗНЗЈВтЖЈЫЎжаШмНтбѕСПЃЌЯћКФ0.01000
molЁЄL-1 Na2S2O3БъзМШмвК13.50 mLЁЃМЦЫуИУЫЎбљжаЕФШмНтбѕЮЊ____________mgЁЄL-1ЁЃ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПЯТСаЪТЪЕЁЂЪТМўЁЂЪТЙЪжагыМзЭщЮоЙиЕФЪЧЃЈ ЃЉ
A. ЬьШЛЦјЕФжївЊГЩЗж B. ЁАЮїЦјЖЋЪфЁБжаЦјЬх
C. УКЦјжаЖО D. УКПѓжаЕФЭпЫЙБЌеЈ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПЯТСаЮяжЪЃКЂйЯЁHNO3ЃЎЂкBaCl2ШмвКЃЛЂлKIШмвКЃЛЂмNaAlO2ШмвКЃЛЂнKSCNШмвКЃЛЂоЫсадK2Cr2O7ШмвКЃЌгыFe2ЃЈSO4ЃЉ3ВЛЗДгІЕФЪЧ
A. ЂйЂо B. ЂмЂо C. ЂлЂм D. ЂйЂмЂо
ВщПДД№АИКЭНтЮі>>
ЙњМЪбЇаЃгХбЁ - СЗЯАВсСаБэ - ЪдЬтСаБэ
КўББЪЁЛЅСЊЭјЮЅЗЈКЭВЛСМаХЯЂОйБЈЦНЬЈ | ЭјЩЯгаКІаХЯЂОйБЈзЈЧј | ЕчаХеЉЦОйБЈзЈЧј | ЩцРњЪЗащЮожївхгаКІаХЯЂОйБЈзЈЧј | ЩцЦѓЧжШЈОйБЈзЈЧј
ЮЅЗЈКЭВЛСМаХЯЂОйБЈЕчЛАЃК027-86699610 ОйБЈгЪЯфЃК58377363@163.com