
【题目】已知A、B、C、D、E、F、G都是元素周期表中短周期主族元素,它们的原子序数依次增大。A是周期表中原子半径最小的元素,D3B中阴、阳离子具有相同的电子层结构,B、C均可分别与A形成10个电子分子,B、C属同一周期,两者可以形成许多种共价化合物,C、F属同一主族,B原子最外电子层的p能级上的电子处于半满状态,C的最外层电子数是内层电子数的3倍,E最外层电子数比最内层多1。请用具体的元素回答下列问题:
(1)E元素原子基态电子排布式____________。
(2)F元素原子的价电子排布图________________。
(3)F、G元素对应的最高价含氧酸中酸性较强的分子式为__________________。
(4)离子半径D+______B3-,第一电离能B______C,电负性C______F(填“<”、“>”或“=”)。
(5)A、C形成的两种常见分子中,其中一种为绿色氧化剂的电子式为_________。
(6)基态G原子中,电子占据的最高能层符号是_______,该能层有________个能级,电子数是_____。该原子有_____种运动状态不同的电子,最高能级符号是_____,未成对电子数为________。
(7)与E同族有4个能层的元素符号为______,它的简化电子排布式为______,与该元素同周期且核电荷数小7的元素在周期表中的位置______________,该元素的价电子排布式为__________,_________满足构造原理(填“是”或“否”)。
【答案】1s22s22p63s23p1 ![]() HClO4 < > >
HClO4 < > > ![]() M 3 7 17 3p 1 Ga [Ar]3d104s24p1 第四周期第VIB族 3d54s1 否
M 3 7 17 3p 1 Ga [Ar]3d104s24p1 第四周期第VIB族 3d54s1 否
【解析】
A、B、C、D、E、F、G都是元素周期表中短周期主族元素,它们的原子序数依次增大,A是周期表中原子半径最小的元素,则A是H元素,D3B中阴、阳离子具有相同的电子层结构,B原子最外电子层的p能级上的电子处于半满状态,为第VIA族元素,B为-3价、D为+1价且D是金属元素,D的原子序数大于B、C,则D为Na元素、B为N元素,B、C均可分别与A形成10个电子分子,B、C属同一周期,两者可以形成许多种共价化合物,C的最外层电子数是内层电子数的3倍,则C是O元素,C、F属同一主族,则F是S元素,E最外层电子数比最内层多1,则E最外层电子数为3,E是Al元素,G的原子序数大于F,且为短周期主族元素,则G是Cl元素,再结合物质结构分析解答。
通过以上分析知,A为H,B为N,C为O,D为Na,E为Al,F为S,G为Cl;
(1)E是Al元素,其原子核外有13个电子,根据构造原理知其基态原子核外电子排布式为1s22s22p63s23p1;
(2)F为S元素,其价电子为3s、3p电子,其价电子排布图为![]() ;
;
(3)元素的非金属性越强,其最高价氧化物的水化物酸性越强,Cl元素的非金属性大于S元素,则F、G元素对应的最高价含氧酸中酸性较强的分子式为HClO4;
(4)电子层结构相同的离子,离子半径随着原子序数的增大而减小,所以离子半径D+<B3;N与O位于同一周期相邻元素,N原子最外电子层的p能级上的电子处于半满状态,电子较O相比难以失去,故第一电离能:B>C;C是O元素、F是S元素,同一主族元素中,电负性随着原子序数的增大而减小,所以电负性C>F,故答案为:<;>;>;
(5)A、C形成的一种绿色氧化剂X有广泛应用,X分子中A、C原子个数比1:1,则X是双氧水,其电子式为![]() ;
;
(6)基态Cl原子核外电子排布式为1s22s22p63s23p5,电子占据最高能层为第三能层,能层符号为M;该能层中有s、p、d三个能级;第三能层中电子数为2+5=7;Cl原子中电子数为17,因此共有17中运动状态不同的电子;最高能级符号为3p;外围电子排布图为:![]() ,核外未成对电子数为1;
,核外未成对电子数为1;
(7)Al位于IIIA族,第四周期IIIA族元素为Ga;简化电子排布式为:[Ar]3d104s24p1;IIIA族位于从左至右的第13列,因此同周期且核电荷数小7的元素在周期表中的位置为第四周期第6列,即第四周期第VIB族;该元素核外电子排布式为:1s22s22p63s23p63d54s1,价层电子排布式为:3d54s1;其满足洪特规则特例,不满足构造原理。


科目:高中化学 来源: 题型:
【题目】在25℃时,密闭容器中X、Y、Z三种气体的初始浓度和平衡浓度如下表:
物质 | X | Y | Z |
初始浓度/mol·L-1 | 0.1 | 0.2 | 0 |
平衡浓度/mol·L-1 | 0.05 | 0.05 | 0.1 |
下列说法错误的是( )
A.增大压强使平衡向生成Z的方向移动,平衡常数增大
B.反应可表示为X+3Y![]() 2Z,其平衡常数为1600
2Z,其平衡常数为1600
C.反应达到平衡时,X的转化率为50%
D.增大X的浓度,Y的转化率增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】固定容积为2 L的密闭容器中发生反应xA(g)+yB(g)![]() zC(g),图1表示T ℃时容器中各物质的量随时间变化的关系,图2表示平衡常数K随温度变化的关系。结合图像判断,下列结论正确的是
zC(g),图1表示T ℃时容器中各物质的量随时间变化的关系,图2表示平衡常数K随温度变化的关系。结合图像判断,下列结论正确的是
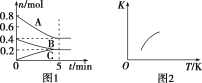
A.该反应可表示为2A(g)+B(g)![]() C(g) ΔH<0
C(g) ΔH<0
B.T ℃时该反应的平衡常数K=6.25
C.当容器中气体密度不再变化时,该反应达到平衡状态
D.T ℃,在第6 min时再向体系中充入0.4 mol C,再次达到平衡时C的体积分数大于0.25
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室用 NH4Cl、盐酸、NaClO2 为原料制备 ClO2 的过程如下图所示,下列说法不正确的是
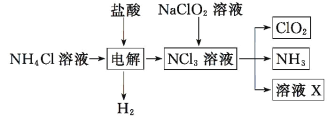
A.X 中大量存在的阴离子有 Cl-和 OH-B.NCl3 的键角比 CH4 的键角大
C.NaClO2 变成 ClO2 发生了氧化反应D.制取 3 mol ClO2 至少需要 0.5mol NH4Cl
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】类比pH的定义,对于稀溶液可以定义pC=-lgC,pKa=-lgKa,常温下,某浓度H2A溶液在不同pH值下,测得pC(H2A)、pC(HA﹣)、pC(A2﹣)变化如图所示,下列说法正确的是
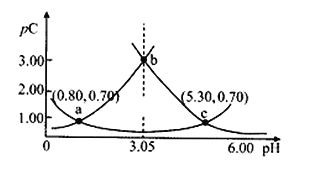
A.随着pH的增大,pC增大的曲线是A2﹣的物质的量浓度的负对数
B.pH=3.50时,c(HA﹣)> c(H2A) > c(A2﹣)
C.b点时c(H2A)·c(A2﹣)/c2(HA﹣)=10﹣4.5
D.pH=3.00~5.30时,c(H2A)+c(HA﹣)+c(A2﹣)先减小后增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】世界水产养殖协会网介绍了一种利用电化学原理净化鱼池中水质的方法,其装置如图所示。下列说法正确的是

A. X为电源负极
B. 若该装置在高温下进行,则净化效率将降低
C. 若有1molNO3-被还原,则有6molH+通过质子膜迁移至阴极区
D. 若BOD为葡萄糖(C6H12O6),则1mol葡萄糖被完全氧化时,理论上电极流出20 mol e-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是一套电化学装置,对其有关说法错误的是( )
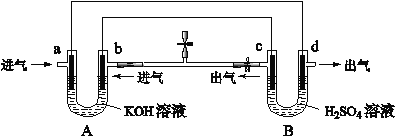
A.装置A是原电池,装置B是电解池
B.反应一段时间后,装置B中溶液pH增大
C.a若消耗1mol CH4,d可产生4mol气体
D.a通入C2H6时的电极反应为 C2H6-14e-+ 18OH-= 2CO32-+ 12H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是某无机化合物的二聚分子,该分子中A、B两种元素都是第三周期的元素,分子中所有原子的最外层电子都达到8个电子的稳定结构。下列说法不正确的是
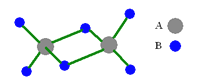
A.该化合物的化学式是Al2Cl6
B.该化合物在固态时所形成的晶体是分子晶体
C.该化合物是离子化合物,在熔融状态下能导电
D.该化合物中存在共价键,且不含有非极性共价键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】叠氮化合物是一类重要的化合物,其中氢叠氮酸(HN3)是一种弱酸,其分子结构可表示为H—N=N≡N,肼(N2H4)被亚硝酸氧化时便可得到氢叠氮酸(HN3),发生的反应为N2H4+HNO2=2H2O+HN3。HN3的酸性和醋酸相近,可微弱电离出H+和N3-。试回答下列问题:
(1)下列有关说法正确的是___(填序号)。
A.HN3中含有5个σ键
B.HN3中的三个氮原子均采用sp2杂化
C.HN3、HNO2、H2O、N2H4都是极性分子
D.N2H4沸点高达113.5℃,说明肼分子间可形成氢键
(2)叠氮酸根能与许多金属离子等形成配合物,如[Co(N3)(NH3)5]SO4,在该配合物中钴显___价;根据价层电子对互斥理论判断SO42-的空间构型为___。
(3)与N3-互为等电子体的分子有___(写两种即可)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com