
【题目】化合物a、b是合成药物的中间体(结构简式及转化如图所示),下列叙述正确的是( )

A.化合物a、b均易溶于水
B.a→b的转化属于酯化反应
C.a、b中均至少有8个碳原子共平面
D.a的含苯环的同分异构体中与a含有相a同取代基的还有4种(不考虑立体异构)
【答案】C
【解析】
A.化合物b没有亲水基团,难溶于水,故A错误;
B.a→b是羧基之间脱水缩合,酯化反应是酸和醇发生的反应,a→b的转化不属于酯化反应,故B错误;
C.C-O单键可以旋转,甲基上的碳原子可能与苯环不在同一平面上,与苯环直接相连的碳原子一定与苯环共面,故a,b中至少有8个碳原子共平面,故C正确;
D.a的含苯环的同分异构体中取代基为2个-COOH和一个-OCH3的共六种,-OCH3的位置确定好,一个羧基位于邻位,与羧基相邻,相间,相对的位置各一种,两个羧基相邻,与-OCH3相间有一种,三个取代基都相间有一种,三个取代基相连一种,共六种,除去a还有5种,故D错误;
答案选C。


科目:高中化学 来源: 题型:
【题目】某溶液中可能存在![]() 、
、![]() 、
、![]() 、
、![]() 、Cl
、Cl![]() 、
、![]() 六种离子中的几种.现进行下列实验:
六种离子中的几种.现进行下列实验:
①取少量溶液滴加KSCN溶液,溶液呈血红色;
②另取少量原溶液滴加盐酸,溶液的棕黄色加深.
据此可以推断,该溶液中肯定不存在的离子是![]()
A.![]() 、
、![]() 、
、![]() B.
B.![]() 、
、![]() 、
、![]()
C.![]() 、
、![]() D.
D.![]() 、
、![]() 、
、![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】今有一混合物的水溶液,含有以下离子中的若干种:![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() ,现取两份100mL的该溶液进行如下实验:
,现取两份100mL的该溶液进行如下实验:
(1)第一份加足量NaOH溶液,加热,收集到标准状况下的气体448mL;
(2)第二份加足量![]() 溶液,得沉淀
溶液,得沉淀![]() ,再用足量盐酸洗涤、干燥后,沉淀质量为
,再用足量盐酸洗涤、干燥后,沉淀质量为![]() .
.
根据上述实验,下列推测正确的是![]()
A.![]() 一定存在
一定存在
B.100mL该溶液中含![]()
C.![]() 不一定存在
不一定存在
D.![]() 不确定,可向原溶液中加入
不确定,可向原溶液中加入![]() 溶液进行检验
溶液进行检验
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】草酸是一种重要的化工产品.实验室用硝酸氧化淀粉水解液制备草酸的装置如图所示(加热、搅拌和仪器固定装置均已略去)。

实验过程如下:
①将一定量的淀粉水解液加入三颈瓶中;
②控制反应液温度在55~60℃条件下,边搅拌边缓慢滴加一定量含有适量催化剂的混酸(65%HNO3与98%H2SO4的质量比为2∶1.5)溶液;
③反应3h左右,冷却,抽滤后再重结晶得草酸晶体;
硝酸氧化淀粉水解液过程中可发生下列反应:
C6H12O6+12HNO3→3H2C2O4+9NO2↑+3NO↑+9H2O
C6H12O6+8HNO3→6CO2+8NO↑+10H2O
3H2C2O4+2HNO3→6CO2+2NO↑+4H2O
(1)检验淀粉是否水解完全所需用的试剂为________;
(2)实验中若混酸滴加过快,将导致草酸产率下降,其原因是_________;
(3)装置C用于尾气吸收,当尾气中n(NO2)∶n(NO)=1∶1时,过量的NaOH溶液能将NO,全部吸收,原因是_________(用化学方程式表示);
(4)与用NaOH溶液吸收尾气相比较,若用淀粉水解液吸收尾气,其优、缺点是________;
(5)草酸重结晶的减压过滤操作中,除烧杯、玻璃棒外,还必须使用属于硅酸盐材料的仪器有_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组离子在指定溶液中能大量共存的是( )
A.遇甲基橙变红的溶液中:K+、Na+、Cl-、SiO32-
B.0.1molL-1NaA1O2溶液中:Na+、NO3-、NH4+、HCO3-
C.常温下,![]() =1012的溶液中:SO32-、SO42-、Na+、Br-
=1012的溶液中:SO32-、SO42-、Na+、Br-
D.澄清透明的溶液中:Fe3+、A13+、I-、SO42-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】磷酸亚铁锂(LiFePO4)电池是新能源汽车的动力电池之一。请回答下列问题:
(1)基态Fe原子的价电子轨道表示式(电子排布图)为____,O2-核外电子有___种运动状态。
(2)锂的紫红色焰色是一种_______光谱,LiFePO4中阴离子VSEPR模型名称为______,中心原子的杂化轨道类型为____。
(3)一般情况下,同种物质固态时密度比液态大,但普通冰的密度比水小,原因是____________;H2O2难溶于CS2,简要说明理由:____________________。
(4)Li2O是离子晶体,其晶体能可通过如图甲的Born - Haber循环计算得到。可知,Li2O晶格能为____kJ/mol。
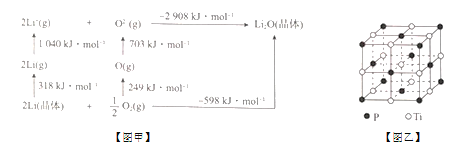
(5)磷化钛熔点高、硬度大,其晶胞如图乙所示。
①磷化钛晶体中Ti原子周围最邻近的Ti数目为____;设晶体中Ti原子与最邻近的P原子之间的距离为r,则Ti原子与跟它次邻近的P原子之间的距离为_______。
②设磷化钛晶体中Ti、P原子半径分别为a pm、b pm,它们在晶体中紧密接触,则该晶胞中原子的空间利用率为_____ (用a、b表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以软锰矿粉末(主要成分MnO2,还含有Al2O3、Fe2O3等杂质)为原料制MnSO4·H2O的工艺流程如下:
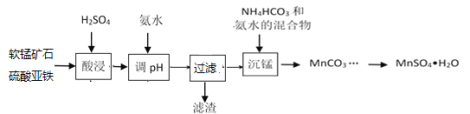
已知:pH>3.3后溶液不存在Fe3+,pH>5.0后溶液不存在Al3+,pH>8后Mn2+开始沉淀。
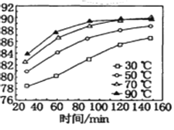
(1)保持其他条件不变,在不同温度下对含软锰矿粉进行酸浸,锰浸出率随时间变化如图。酸浸的最佳温度与时间分别为________℃、______min。
(2)“酸浸”时,会将Fe2+氧化至Fe3+,所发生的反应离子方程式为__________。
(3)酸浸时要加入硫酸,硫酸浓度不能过大或者过小。当硫酸浓度过小时,酸浸会有红褐色残渣出现,原因是_____________________________。
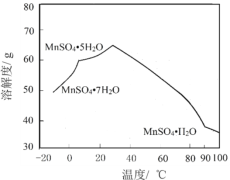
(4)MnSO4在水中的溶解度与温度关系如图。由MnCO3获得较纯净的MnSO4H2O晶体的方法是:将MnCO3溶于_________,控制温度为_________以上结晶,得到MnSO4H2O晶体,洗涤、烘干。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,用浓度为![]() 的盐酸分别逐滴加入到
的盐酸分别逐滴加入到![]() 的两种一元碱MOH、ROH溶液中,pH随盐酸溶液体积的变化如图所示.下列说法正确的是
的两种一元碱MOH、ROH溶液中,pH随盐酸溶液体积的变化如图所示.下列说法正确的是![]()
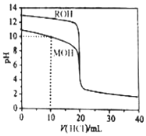
A.![]() 时,溶液中微粒浓度的关系是:
时,溶液中微粒浓度的关系是:![]()
B.将上述MOH、ROH溶液等体积混合后,用盐酸滴定至MOH恰好反应时,溶液中离子浓度的关系是:![]()
C.![]() 时,溶液中微粒浓度的关系是:
时,溶液中微粒浓度的关系是:![]()
D.![]() 时,不可能存在:
时,不可能存在:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式正确的是
A.向碳酸氢钙(aq)中加入少量氢氧化钾(aq):Ca2++2HCO3-+2OH-=CaCO3↓+2H2O+CO32-
B.氯化铵与氢氧化钠两种浓溶液混合:OH- + NH4+=H2O + NH3↑
C.实验室制Cl2:MnO2+4HCl(浓)![]() Mn2+ +2Cl- +Cl2↑+2H2O
Mn2+ +2Cl- +Cl2↑+2H2O
D.氯气与水反应:Cl2+H2O ![]() 2H++Cl-+ClO-
2H++Cl-+ClO-
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com