
【题目】磷酸亚铁锂(LiFePO4)电池是新能源汽车的动力电池之一。请回答下列问题:
(1)基态Fe原子的价电子轨道表示式(电子排布图)为____,O2-核外电子有___种运动状态。
(2)锂的紫红色焰色是一种_______光谱,LiFePO4中阴离子VSEPR模型名称为______,中心原子的杂化轨道类型为____。
(3)一般情况下,同种物质固态时密度比液态大,但普通冰的密度比水小,原因是____________;H2O2难溶于CS2,简要说明理由:____________________。
(4)Li2O是离子晶体,其晶体能可通过如图甲的Born - Haber循环计算得到。可知,Li2O晶格能为____kJ/mol。
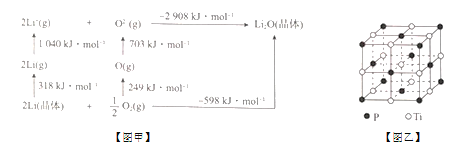
(5)磷化钛熔点高、硬度大,其晶胞如图乙所示。
①磷化钛晶体中Ti原子周围最邻近的Ti数目为____;设晶体中Ti原子与最邻近的P原子之间的距离为r,则Ti原子与跟它次邻近的P原子之间的距离为_______。
②设磷化钛晶体中Ti、P原子半径分别为a pm、b pm,它们在晶体中紧密接触,则该晶胞中原子的空间利用率为_____ (用a、b表示)。
【答案】![]() 10 发射 正四面体 sp3 液态水中分子间相对自由,冰中每个水分子中的氢原子和氧原子共参与形成4个氢键,水分子形成正四面体,分子间距离增大,密度减小 H2O2为极性分子,CS2为非极性分子,根据相似相溶原理,H2O2难溶于CS2 2908 12
10 发射 正四面体 sp3 液态水中分子间相对自由,冰中每个水分子中的氢原子和氧原子共参与形成4个氢键,水分子形成正四面体,分子间距离增大,密度减小 H2O2为极性分子,CS2为非极性分子,根据相似相溶原理,H2O2难溶于CS2 2908 12 ![]() r
r 
【解析】
(1) Fe的电子排布式是[Ar]3d64s2, O2-核外电子总数为10,其原子核外有10种运动状态不同的电子;
(2)PO43-中P原子价层电子对个数=![]() ,且不含孤电子对,根据价层电子对互斥理论判断该微粒空间构型及P原子的杂化形式;
,且不含孤电子对,根据价层电子对互斥理论判断该微粒空间构型及P原子的杂化形式;
(3) 液态水中分子间相对自由,冰中每个水分子中的氢原子和氧原子共参与形成4个氢键,水分子形成正四面体,使水分子之间间隙增大,密度变小,导致固态H2O的密度比其液态时小, H2O2为极性分子,而CS2为非极性溶剂,根据“相似相溶”规律可知;
(4) 晶格能是气态离子形成1mol离子晶体释放的能量
(5) ①有一个Ti原子位于体心,在三维坐标中,体心Ti原子可以形成3个面,每一个形成的面上有4个Ti原子;由晶胞的截图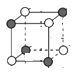 可知,顶点Ti原子与小立方体顶点P原子最邻近,与体对角线的P原子次近邻;
可知,顶点Ti原子与小立方体顶点P原子最邻近,与体对角线的P原子次近邻;
②磷化钛晶胞为面心立方密堆积,晶胞中P原子位于顶点和面心上,Ti位于棱边上和体内,利用均摊法计算。
(1) Fe的电子排布式是[Ar]3d64s2,价电子轨道表示式(电子排布图)为![]() ,故答案为:
,故答案为:![]() ; O2-核外电子总数为10,其原子核外有10种运动状态不同的电子,故答案为10;
; O2-核外电子总数为10,其原子核外有10种运动状态不同的电子,故答案为10;
(2)紫红色波长介于380-435nm之间,是一种发射光谱,故答案为:发射;PO43-中P原子价层电子对个数=![]() ,且不含孤电子对,据价层电子对互斥理论判断该微粒VSEPR模型为正四面体形、P原子的杂化形式为sp3;故答案为正四面体、sp3;
,且不含孤电子对,据价层电子对互斥理论判断该微粒VSEPR模型为正四面体形、P原子的杂化形式为sp3;故答案为正四面体、sp3;
(3) 液态水中分子间相对自由,冰中每个水分子中的氢原子和氧原子共参与形成4个氢键,水分子形成正四面体,使水分子之间间隙增大,密度变小,导致固态H2O的密度比其液态时小,故答案为:液态水中分子间相对自由,冰中每个水分子中的氢原子和氧原子共参与形成4个氢键,水分子形成正四面体,分子间距离增大,密度减小; H2O2为极性分子,而CS2为非极性溶剂,根据“相似相溶”规律可知,H2O2难溶于CS2,
故答案为:H2O2为极性分子,CS2为非极性分子,根据相似相溶原理,H2O2难溶于CS2;
(4) 图中: 2Li(晶体)+1/2O2(g)=Li2O(晶体)的△H=-598KJ·mol1 ,Li原子的第一电离能为Li原子失去1个电子所需要的能量,所以其第一电离能为1040/2kJ·mol-1=520kJ·mol-1;O=O键键能为氧气分子变为氧原子所需能量,其键能=2×249kJ·mol-1=498kJ·mol-1;晶格能是气态离子形成1mol离子晶体释放的能量,所以其晶格能为2908kJ·mol-1,故答案为:2908;
(5) ①根据磷化钛晶体可知,有一个Ti原子位于体心,在三维坐标中,体心Ti原子可以形成3个面,每一个形成的面上有4个Ti原子,则该Ti原子最邻近的Ti的数目为3×4=12个;由晶胞的截图 可知,顶点Ti原子与小立方体顶点P原子最邻近,与体对角线的P原子次近邻,Ti原子与跟它最邻近的P原子之间的距离为r,则跟它次邻近的P原子之间的距离为
可知,顶点Ti原子与小立方体顶点P原子最邻近,与体对角线的P原子次近邻,Ti原子与跟它最邻近的P原子之间的距离为r,则跟它次邻近的P原子之间的距离为![]() =
=![]() r,故答案为:12;
r,故答案为:12;![]() r;
r;
②磷化钛晶胞为面心立方密堆积,晶胞中P原子位于顶点和面心上,Ti位于棱边上和体内,每个晶胞中含有的P原子个数为8×![]() +6×
+6×![]() =4,含有的Ti原子个数为 12×
=4,含有的Ti原子个数为 12×![]() +1=4,P原子和Ti原子的体积之和为
+1=4,P原子和Ti原子的体积之和为![]() π(a+b)3×4 pm3,晶胞的边长(2a+2b)pm,体积为(2a+2b)3pm3,则在磷化钛晶体中原子的空间利用率为
π(a+b)3×4 pm3,晶胞的边长(2a+2b)pm,体积为(2a+2b)3pm3,则在磷化钛晶体中原子的空间利用率为 ×100%,故答案为:
×100%,故答案为: ×100%;
×100%;


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】25℃时,向20mL0.2mol·L-1NaCN溶液中加入0.2mol·L-1的盐酸,溶液pH随所加盐酸体积的变化如图所示(M>7)。下列说法不正确的是

A. 25℃时,K(HCN)≈10-9.4
B. b点时,c(CN-)<c(HCN)
C. c点时,c(Cl-)>c(H+)+c(HCN)
D. a、b、c三点时,水的电离程度:a>b>c
查看答案和解析>>
科目:高中化学 来源: 题型:
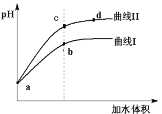
【题目】已知T ℃时两种弱酸的电离平衡常数如下表。将pH和体积均相同的两种酸溶液M、N分别稀释,其pH随加水体积的变化如图所示。下列叙述不正确的是
弱酸 | HNO2 | CH3COOH |
电离平衡常数 | 5.0×10-4 | 1.7×10-5 |
A.曲线Ⅰ代表CH3COOH溶液
B.M、N两溶液分别与NaOH恰好中和后,溶液中n(Na+)相同
C.溶液中水的电离程度:b点<c点
D.从c点到d点,溶液中 保持不变(其中HA、A-分别代表相应的酸和酸根离子)
保持不变(其中HA、A-分别代表相应的酸和酸根离子)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物![]() 是桥环烯烃类化合物,在药物合成、材料化学以及生命科学中有着重要的应用。下列关于该化合物的叙述正确的是( )
是桥环烯烃类化合物,在药物合成、材料化学以及生命科学中有着重要的应用。下列关于该化合物的叙述正确的是( )
A.分子式为C11H10
B.—氯代物有5种(不考虑立体异构)
C.不能形成高分子化合物
D.1mol该化合物最多能与3molH2发生加成反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物a、b是合成药物的中间体(结构简式及转化如图所示),下列叙述正确的是( )

A.化合物a、b均易溶于水
B.a→b的转化属于酯化反应
C.a、b中均至少有8个碳原子共平面
D.a的含苯环的同分异构体中与a含有相a同取代基的还有4种(不考虑立体异构)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲基丙烯酸甲酯是合成有机玻璃的单体,其合成方法之一如下:CH3OC≡CH+CH3OH+A![]() CH2=C(CH3)COOCH3,下列说法正确的是( )
CH2=C(CH3)COOCH3,下列说法正确的是( )
A.已知该反应的原子利用率为100%,则A为CO2
B.CH3OH和甘油互为同系物
C.CH3C≡CH与丙烯的性质相似,则该物质可以发生加成、氧化反应
D.能与NaHCO3反应的CH2=C(CH3)COOCH3的同分异构体有9种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是25℃时弱酸的电离平衡常数,下列说法正确的是
CH3COOH | HClO | H2CO3 |
Ka=1.8×10—5 | Ka=3.0×10—8 | Ka1=4.1×10—7 Ka2=5.6×10—11 |
A.根据表中数据可知,相同浓度CH3COONa和NaClO的混合溶液中,各种离子浓度的大小关系是:c(Na+)>c(ClO﹣)>c(CH3COO﹣)>c(OH﹣)>c(H+)
B.根据表中数据可知,次氯酸钠溶液中通入少量CO2的离子方程式为:2ClO﹣+CO2+H2O=CO32﹣+2HClO
C.向0.1mol·L-1CH3COOH溶液中加入少量水,溶液中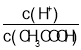 减小
减小
D.室温下,将碳酸钠溶液加热至70℃,溶液的中的OH—数目增多
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃,将浓度均为0.1mol/L的HA溶液Va mL和BOH溶液Vb mL混合,保持Va+Vb=100mL,生成物BA易溶于水。Va、Vb与混合液pH的关系如下图。下列叙述错误的是

A.HA一定是弱酸
B.BOH可能是强碱
C.z点时,水的电离被促进
D.x、y、z点时,溶液中都存在c(A-)+c(OH-)=c(B+)+c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中科院深圳先进技术研究院成功研发了一种高效低成本储能电池——“铝一石墨”双离子电池,电池总反应为Al+xC+Li++PF6 -![]() AlLi+Cx PF6下列有关该电池的说法正确的是
AlLi+Cx PF6下列有关该电池的说法正确的是
A. 放电时,PF6-向正极移动
B. 放电时,负极反应为A1-3e-====Al3+
C. 充电时,两个电极增加的质量相等
D. 充电时,阳极反应为xC+PF6--e-==CxPF6
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com