
【题目】溴苯是一种化工原料,实验室合成溴苯的装置示意图及有关数据如下:按以下合成步骤回答问题:
已知:C6H6(苯)+Br2(溴)→C6H5Br(溴苯)+HBr↑(需要铁粉作催化剂);
液溴、溴化氢均可与氢氧化钠反应;苯、溴苯不与氢氧化钠反应;溴化氢易溶于水。

苯 | 溴 | 溴苯 | |
密度/g·cm-3 | 0.88 | 3.10 | 1.50 |
沸点/℃ | 80 | 59 | 156 |
水中溶解度 | 微溶 | 微溶 | 微溶 |
(1)仪器c的名称_________。
(2)在a中加入15 mL无水苯和少量铁屑。在b中小心加入4.0 mL 液态溴。向a中滴入几滴溴,有白雾产生,是因为生成了__________气体,继续滴加至液溴滴完。装置d的作用是____________________。
(3)液溴滴完后,经过下列步骤分离提纯:
①向a中加入10 mL水,然后过滤除去未反应的铁屑;
②滤液依次用10 mL水、8 mL10%的NaOH溶液、10 mL水洗涤。NaOH溶液洗涤的作用是_____________________,第二次水洗的目的为________________。
③向分出的粗溴苯中加入少量的无水氯化钙,静置、过滤。加入氯化钙的目的是______。
(4)经过上述分离操作后,粗溴苯中还含有部分杂质,要进一步提纯,选择的装置为___(填入正确选项前的字母)。

(5)在该实验中,a的容积最适合的是________(填入正确选项前的字母)。
A.25 mL B.50 mL C.250 mL D.500 mL
【答案】球形冷凝管HBr防倒吸,吸收HBr、Br2除去HBr和未反应的Br2除去NaOH溶液干燥bB
【解析】
(1)根据仪器构造可知仪器c的名称为球形冷凝管。
(2)苯与液溴反应生成HBr,HBr易挥发,遇水蒸气形成白雾;苯的卤代反应是放热反应,液溴易挥发,所以尾气中有HBr及挥发出的Br2,用氢氧化钠溶液吸收,防止污染大气,即装置d的作用是防倒吸,吸收HBr、Br2;
(3)②制取得到的溴苯中含有未反应的Br2和苯,Br2与NaOH可以发生反应:Br2+2NaOH=NaBr+NaBrO+H2O,产生的物质容易溶于水,所以滤液用8 mL10%的NaOH溶液洗涤的作用是除去HBr和未反应的Br2;由于氢氧化钠过量,所以第二次水洗的目的为除去NaOH溶液。
③氯化钙吸水性强,因此向分出的粗溴苯中加入少量的无水氯化钙,静置、过滤的目的是干燥溴苯;
(4)在蒸馏操作中,温度计的水银球要在蒸馏烧瓶的支管口附近。排除a、d,而在c中使用的是球形冷凝管,容易使产品滞留,使产品不能全部收集到锥形瓶中,因此仪器选择及安装都正确的是b。答案选b;
(5)在a中加入15mL无水苯和少量铁屑。在b中小心加入4.0mL液态溴也要进入仪器a中,还向a中加入10mL水,此时液态物质的体积是15mL+4mL+10mL=29mL,根据液态物质反应时不能超出容器容积的2/3可知,仪器的规格是50mL烧瓶,答案选B。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】
AlN 氮化铝是重要的半导体材料,Ga(镓)、P、As(砷)都是形成化合物半导体材料的重要元素。回答下列问题:
(1)As基态原子的电子占据了______个能层,最高能级的电子排布式为______。和As位于同一周期,且未成对电子数也相同的元素还有______种。
(2)元素周期表中,与P紧邻的4种元素中电负性最大的是______ (填元案符号)。Si、P、S三种元素的 第一电离能由大到小的顺序是______。
(3)NH3、PH3、AsH3三者的沸点由高到低的顺序是______。原因是______。
(4)白磷是由P4分子形成的分子晶体,P4分子呈正四面体结构,P原子位于正四面体的四个顶点,则P原子的杂化形式为_____,白磷易溶于CS2,难溶于水,原因是__________________。
(5)采用GaxIn1-xAs(镓铟砷)等材料,可提高太阳能电池的效率。GaxIn1-xAs立方体形晶胞中每个顶点和面心都有一个原子,晶胞内部有4 个原子,则该晶胞中含有_________个砷原子。
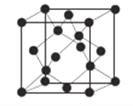
(6)AlN晶体的晶胞结构与金刚石相似(见下图),设晶胞的边长为ɑ pm,NA表示阿伏加德罗常数,则该晶体的密度为__________g·cm-3。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于元素周期表的说法正确的是
A.元素周期表有7个周期,8个主族
B.元素周期表有18个纵行,共16个族
C.短周期元素中可能有副族元素
D.最外层电子数相同的元素一定在同一族
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“垃圾是放错了位置的资源”,应该分类回收.生活中废弃的铁锅、铝制的易拉罐、铜导线等可以归为一类加以回收,它们属于( )
A.氧化物
B.盐
C.金属或合金
D.碱
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯化铬晶体(CrCl3·6H2O)是一种重要的工业原料,工业上常用铬酸钠(Na2CrO4)来制备。实验室以红矾钠(Na2Cr2O7)为原料制备CrCl3·6H2O的流程如下:

已知:① Cr2O72-+H2O![]() 2CrO42-+2H+;
2CrO42-+2H+;
② CrCl3·6H2O不溶于乙醚,易溶于水、乙醇,易水解。
(1)写出碱溶发生反应的化学方程式____________________________________,所加40%NaOH不宜过量太多的原因是______________________________。
(2)还原时先加入过量CH3OH再加入10%HCl,生成CO2,写出该反应的离子方程式_________________,反应后从剩余溶液中分离出CH3OH的实验方法是_____________。
(3)使用下列用品来测定溶液的pH,合理的是_________(填字母)。
A.酚酞溶液 B.石蕊试纸 C.pH计
(4)请补充完整由过滤后得到的固体Cr(OH)3制备CrCl3·6H2O的实验方案:将过滤后所得的洁净固体 _______________________,蒸发浓缩,__________,过滤, ______________,低温干燥,得到CrCl3·6H2O(实验中可供选择的试剂:盐酸、硫酸、蒸馏水、乙醇、乙醚)。
(5)若取原料红矾钠26.2g,实验最终得到氯化铬晶体42.64g,则该实验的产率为_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】人们的衣、食、住、行均与化学有密切密切的联系。
(1)服装面料种类繁多。下列面料中不属于天然纤维的是__________(填序号)。
a、棉和麻 b、丝和毛 c、涤纶和锦纶
(2)营养均衡有利于身体健康。
①为人体提供能量的主要营养物质是糖类、____________和蛋白质。
②蛋白质是构成人体细胞的基础物质。下列食品中富含蛋白质的是_________(填序号)。
a、香蕉 b、牛奶 c、花生油 d、马铃薯
③维生素是人体需要的营养物质。下图为某品牌维生素C泡腾片说明书的部分内容。该泡腾片中添加的着色剂是___________,甜味剂是___________。

(3)居室环境污染严重危害我们的健康。装修材料挥发出的___________(写名称)和苯是常见的环境污染物。存在于石料中的氡因为具有___________性,也是居室环境污染物之一。
(4)汽车和飞机是重要的交通工具,制造其轮胎的主要材料是__________(填序号)。
a、塑料 b、橡胶 c、玻璃钢 d、钛合金
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用铁片与稀硫酸反应制取氢气时,下列措施不能使氢气生成速率加大的是
A.加热B.增加Fe的质量
C.滴加几滴CuSO4溶液D.适当增加稀硫酸的浓度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚砷酸(H3AsO3)在溶液中存在多种微粒形态,各种微粒物质的量分数与溶液pH关系如下图所示。下列说法中,不正确的是
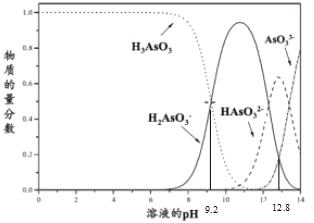
A. K3AsO3溶液中的水解方程式:AsO33-+H2O![]() HAsO32-+OH-
HAsO32-+OH-
B. pH=12.8时,c(HAsO32-) >c(H2AsO3-)=c(AsO33-)
C. pH = 12时,溶液中c(H2AsO3-) + 2c(HAsO32-) + 3c(AsO33-) + c(OH-) = c(H+)
D. pH=9.2时,在H2AsO3-和H3AsO3的混合溶液中:c(H2AsO3-):c(H3AsO3)=1:1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上用丁烷催化脱氢侧备丁烯:C4H10(g)![]() CH4(g)+H2(g)(正反应吸热)。将丁烷和氢气以一定的配比通过填充有催化剂的反应器(氢气的作用是活化催化剂),反应的平衡转化率、产率与温度、投料比有关。下列判断不正确的是
CH4(g)+H2(g)(正反应吸热)。将丁烷和氢气以一定的配比通过填充有催化剂的反应器(氢气的作用是活化催化剂),反应的平衡转化率、产率与温度、投料比有关。下列判断不正确的是
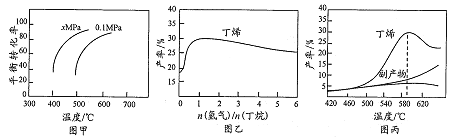
A. 由图甲可知,x小于0.1
B. 由图乙可知,丁烯产率先增大后减小,减小的原因是氢气是产物之一,随着n(氢气)/n(丁烷)增大,逆反应速 率减小
C. 由图丙可知产率在590℃之前随温度升高面增大的原因可能是溫度升高平衡正向移动
D. 由图丙可知,丁烯产率在590℃之后快速降低的主要原因为丁烯高温分解生成副产物
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com