
【题目】硫酸钠和硫酸溶液等体积混合后,H+浓度为0.3 mol·L-1,SO42-浓度为0.4 mol·L-1,则混合溶液中Na+浓度为
A.0.05 mol·L-1B.0.2 mol·L-1C.0.5 molD.0.5 mol·L-1
 一线名师提优试卷系列答案
一线名师提优试卷系列答案科目:高中化学 来源: 题型:
【题目】t℃时,在体积不变的密闭容器中发生反应:X(g)+3Y(g)2Z(g),各组分在不同时刻的浓度如表:
物质 | X | Y | Z |
初始浓度/(molL﹣1) | 0.1 | 0.2 | 0 |
2min末浓度/(molL﹣1) | 0.08 | a | b |
平衡浓度/(molL﹣1) | 0.05 | 0.05 | 0.1 |
下列说法正确的是( )
A.平衡时,X的转化率为5%
B.t℃时,该反应的平衡常数为40
C.增大平衡后的体系压强,v(正)增大,v(逆)减小,平衡向正反应方向移动
D.2 min内,用Y的变化量表示的平均反应速率v(Y)=0.03 molL﹣1min﹣1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以铬铁矿[Fe(CrO2)2]为原料可制备K2Cr2O7和金属铬。实验流程如下:
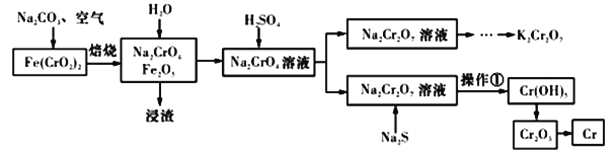
已知:2CrO42-+2H+=Cr2O72-+H2O。pH<3.0,CrO42-含量极小。
(1)写出铬铁矿焙烧转化为Na2CrO4的化学反应方程式:_____________________。焙烧时不能使用陶瓷容器的原因是________________________________________。
(2)判断加入稀硫酸的量已经足量的标准是_______________________________________。
(3)操作①包括过滤和洗涤。实验室洗涤沉淀的操作是________________________________。
(4)Na2S的作用是调节溶液的酸碱度和_____________________。
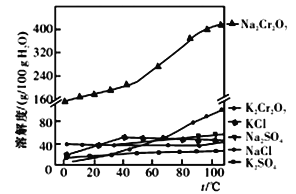
(5)Fe3+在pH为3.7时可完全转化为Fe(OH)3。在上述流程中所得Na2Cr2O7溶液中含有少量Fe3+。请结合上图有关物质的溶解度曲线,设计由Na2Cr2O7溶液制备K2Cr2O7固体的实验方案(实验中须选用的试剂:硫酸溶液、NaOH溶液、KCl固体、蒸馏水):
步骤①除杂质:__________________________________________________________________;
步骤②制备K2Cr2O7固体:__________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】表是25℃时四种酸的电离平衡常数:
化学式 | CH3COOH | HA | HNO2 | H2CO3 |
Ka | Ka=1.8×10﹣5 | Ka=4.9×10﹣10 | Ka=4.6×10﹣4 | Ka1 =4.1×10﹣7 |
(1)用离子方程式表示NaNO2溶液呈碱性的原因
(2)25℃时,向向0.1molL﹣1 CH3COOH溶液中滴加NaOH溶液至c(CH3COOH):c(CH3COO﹣)=5:9,此时溶液pH=
(3)写出NaA溶液中通少量CO2的离子方程式
(4)25℃时,等物质的量浓度的HA、NaA混合溶液呈碱性,溶液中各离子浓度的大小顺序为
(5)已知HNO2不稳定,在稀溶液中也易分解生成NO与NO2 , 某同学分别取少量NaCl溶液与NaNO2溶液于试管中,分别滴加浓醋酸,以此来鉴别失去标签的NaCl溶液和NaNO2溶液,该方法(填“可行”或“不可行”),理由是
(6)已知NaHCO3溶液中存在HCO3H++CO32﹣ , 加水稀释时溶液中的c(H+)将(填“增大”或“减小”)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】磷酸铁锂电池广泛应用于电动自行车电源,其工作原理如图所示,LixC6和Li1-xFePO4为电极材料,电池反应式为: LixC6+Li1-xFePO4=LiFePO4+6C(x<1)。下列说法错误的是
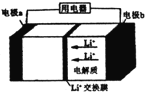
A. 放电时,电极b是负极
B. 放电时,电路中通过0.2mol电子,正极会增重1.4g
C. 充电时,电极a的电极反应式为:6C+xLi++xe-=LixC6
D. 若Li1-xFePO4电极中混有铁单质,会造成电池短路
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于0.1 mol/L碳酸钠溶液的叙述正确的是( )
A.溶液中阴离子的物质的量为0.1 mol
B.加水稀释时水解平衡向正反应方向移动,溶液中所有离子浓度均减小
C.升高温度,水解平衡向正反应方向移动
D.加入氢氧化钠固体,可以使溶液中c(Na+):c(CO ![]() 2﹣)=2:1
2﹣)=2:1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com