
【题目】反应 A+B→C(△H<0)分两步进行 ①A+B→X (△H>0)②X→C(△H<0)下列示意图中,能正确表示总反应过程中能量变化的是( )
A.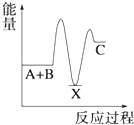
B.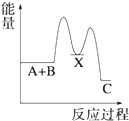
C.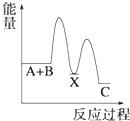
D.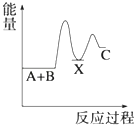
 小学学习好帮手系列答案
小学学习好帮手系列答案 小学同步三练核心密卷系列答案
小学同步三练核心密卷系列答案科目:高中化学 来源: 题型:
【题目】现有金属单质A、B、C和气体甲、乙、丙以及物质D、E、F、G、H,它们之间的相互转化关系如下图所示(图中有些反应的生成物和反应的条件没有标出)。

请回答下列问题:
(1)写出下列物质的化学式:B _______、丙 ________、乙 ________、F________、H_____。
(2)写出下列反应的化学方程式:
反应①__________________________________________________________________ ;
反应⑤___________________________________________________________________;
反应⑥ __________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CuS能与HNO3溶液反应,其中S元素被氧化为+6价,且还原产物NO与NO2在同温同压下体积比为1:1,则参加反应的CuS与被还原的HNO3物质的量比为
A. 1:4 B. 1:11 C. 1:6 D. 1:7
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乳酸亚铁([CH3CH(OH)COO]2Fe·3H2O,Mr=288)是一种常用的补铁剂,可通过乳酸与碳酸亚铁反应制得:CH3CH(OH)COOH+FeCO3+2H2O―→[CH3CH(OH)COO]2Fe·3H2O+CO2↑。已知FeCO3易被氧化:4FeCO3+6H2O+O2===4Fe(OH)3+4CO2。某兴趣小组用FeCl2(用铁粉和稀盐酸制得)和NH4HCO3制备FeCO3的装置示意图如下:
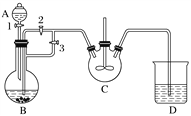
回答下列问题:
(1)NH4HCO3盛放在装置__________(填字母)中,该装置中涉及的主要反应的离子方程式________________________________________________________________________。
(2)将生成的FeCl2溶液和NH4HCO3溶液混合时的操作是____________________。
(3)将制得的FeCO3加入到足量乳酸溶液中,再加入少量铁粉,75 ℃下搅拌反应。铁粉的作用是________________________________________________________________________,反应结束后,无需过滤,除去过量铁粉的方法是_________________________________.
(4)经查阅文献后,该兴趣小组用铈(Ce)量法测定产品中Fe2+的含量。取2.880 g产品配成100 mL溶液,每次取20.00 mL,进行必要处理,用0.100 0 mol·L-1 Ce(SO4)2标准溶液滴定至终点,平均消耗Ce(SO4)2 19.70 mL。滴定反应如下:Ce4++Fe2+===Ce3++Fe3+,则产品中乳酸亚铁的质量分数为______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关热化学方程式及其叙述正确的是( )
A.H2的燃烧热为285.8 kJ/mol,则H2O电解的热化学方程式为2H2O(l)═2H2(g)+O2(g)△H=+285.8 kJ/mol
B.1 mol CH4完全燃烧生成CO2(g)和H2O(l)时放出890 kJ的热量,其热化学方程式为 ![]() CH4(g)+O2(g)═
CH4(g)+O2(g)═ ![]() CO2(g)+H2O(l)△H=﹣445 kJ/mol
CO2(g)+H2O(l)△H=﹣445 kJ/mol
C.已知2C(s)+O2(g)═2CO(g)△H=﹣221 kJ/mol,则C的燃烧热为110.5 kJ/mol
D.HF与NaOH溶液反应:H+(aq)+OH﹣(aq)═H2O(l)△H=﹣57.3 kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】四氯化钛是生产金属钛及其化合物的重要中间体。某校化学课外活动小组准备利用下图装置制备四氯化钛{部分夹持仪器已略去)。

资料表明:室温下,四氯化钛为无色液体,熔点:-25℃,沸点:136.4℃。在空气中与水蒸气发生反应,形成发烟现象,生成二氧化钛固体。在650~850℃下,将氯气通过二氧化钛和炭粉的混合物可得到四氯化钛和一种有毒气体。回答下列问题:
(1)A处分液漏斗上方的胶皮管的作用是_______;
(2)实验中B装置中选用的试剂为______,该装置的作用是_________;
(3)D中物质制备的化学方程式为_________;
(4)E处球形冷凝管的作用是__________,该装置冷却水应从______(填“c”或“d")口通入;
(5)仪器F中盛装的物质是__________;
(6)该实验设计略有缺陷,请指出其不足之处: _________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在氯水中存在多种分子和离子,它们在不同的反应中表现出各自的性质。下列实验现象和结论一致且正确的是( )
A. 加入有色布条,一会儿有色布条褪色,说明溶液中有Cl2存在
B. 溶液呈浅黄绿色,且有刺激性气味,说明有Cl2分子存在
C. 用盐酸酸化后,滴入AgNO3溶液产生白色沉淀,说明氯水中有Cl-存在
D. 加入NaOH溶液,氯水黄绿色消失,说明有HClO分子存在
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】R2O82-离子在一定条件下可以把Mn2+离子氧化,若反应后R2O82-离子变为RO42-离子,又知反应中氧化剂和还原剂的物质的量之比为5︰2,Mn2+离子被氧化后的化合价为
A. 4 B. 5 C. 6 D. 7
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com