
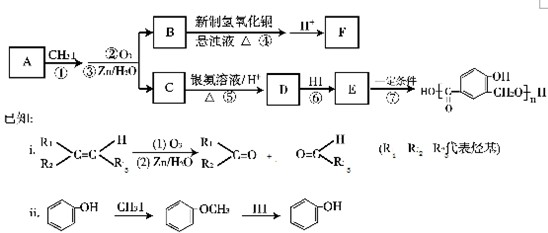
 ,由信息ii可知,逆推可知D为
,由信息ii可知,逆推可知D为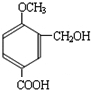 ,C发生氧化反应、酸化生成D,A与CH3I发生信息ii中的第一步反应生成,再发生臭氧氧化反应生成B与C,故C为
,C发生氧化反应、酸化生成D,A与CH3I发生信息ii中的第一步反应生成,再发生臭氧氧化反应生成B与C,故C为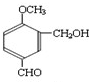 ,结合i信息可知A应为
,结合i信息可知A应为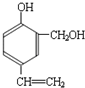 ,据此解答.
,据此解答. ,由信息ii可知,逆推可知D为
,由信息ii可知,逆推可知D为 ,C发生氧化反应、酸化生成D,A与CH3I发生信息ii中的第一步反应生成,再发生臭氧氧化反应生成B与C,故C为
,C发生氧化反应、酸化生成D,A与CH3I发生信息ii中的第一步反应生成,再发生臭氧氧化反应生成B与C,故C为 ,结合i信息可知A应为
,结合i信息可知A应为 ,
, ;B的结构式为
;B的结构式为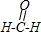 ,故答案为为:
,故答案为为: ;
;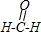 ;
; ,含氧官能团有羟基、羟基、醚键,反应⑦E发生缩聚反应生成高聚物,故答案为:醛基、醚键;缩聚反应;
,含氧官能团有羟基、羟基、醚键,反应⑦E发生缩聚反应生成高聚物,故答案为:醛基、醚键;缩聚反应;| △ |
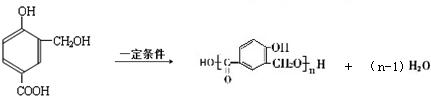 ,
,| △ |
 ;
; ,故答案为:
,故答案为: ;
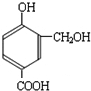
; )的分子少一个CH2,且H具有如下性质:①一定条件下能发生水解反应,含有酯基,②能发生银镜反应,含有醛基,④1mol H与足量的浓溴水反应质量增加158g,应含有酚羟基,可知含有甲酸形成的酯基、酚羟基,生成物中溴原子的质量为160g,物质的量为2mol,且1molH与2mol溴发生取代反应,③核磁共振氢谱有五个吸收峰,不可能含有3个取代基(3个取代基不可能相同,超过5个吸收峰),应含有2个取代基,且处于对位,符合条件的H的结构简式为:
)的分子少一个CH2,且H具有如下性质:①一定条件下能发生水解反应,含有酯基,②能发生银镜反应,含有醛基,④1mol H与足量的浓溴水反应质量增加158g,应含有酚羟基,可知含有甲酸形成的酯基、酚羟基,生成物中溴原子的质量为160g,物质的量为2mol,且1molH与2mol溴发生取代反应,③核磁共振氢谱有五个吸收峰,不可能含有3个取代基(3个取代基不可能相同,超过5个吸收峰),应含有2个取代基,且处于对位,符合条件的H的结构简式为: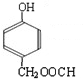 ,
, .
.


 直通贵州名校周测月考直通名校系列答案
直通贵州名校周测月考直通名校系列答案科目:高中化学 来源: 题型:
| A、电解精炼铜时,同一时间内阳极溶解铜的质量与阴极析出铜的质量相等 |
| B、合成氨生产过程中将NH3液化分离,可加快正反应速率,提高N2、H2的转化率 |
| C、对于△H<0,△S>0的反应,不仅能自发进行,反应速率也很快 |
| D、S(g)+O2(g)=SO2(g)△H1,S(s)+O2(g)=SO2(g)△H2;则△H1<△H2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
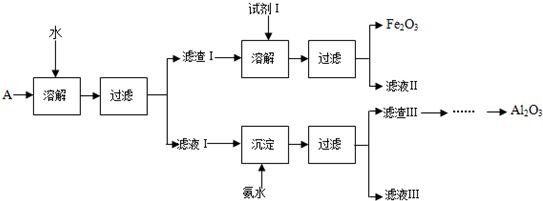
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
238 94 |
238 94 |
A、
| ||||
B、
| ||||
C、
| ||||
D、
|
查看答案和解析>>
科目:高中化学 来源: 题型:

| A、过程①加入的药品顺序为:Na2CO3溶液→BaCl2溶液→NaOH溶液→加盐酸后过滤 |
| B、在过程③中将MgCl2?6H2O灼烧即可制得无水MgCl2 |
| C、工业上通过电解饱和MgCl2溶液制取金属镁 |
| D、过程⑤反应后溶液呈强酸性,生产中需解决其对设备的腐蚀问题 |
查看答案和解析>>
科目:高中化学 来源: 题型:
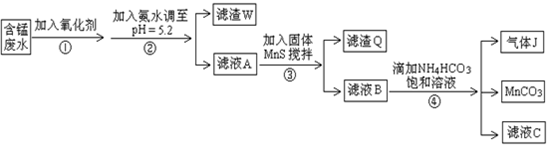
| 沉淀物 | Fe(OH)3 | Al(OH)3 | Cu(OH)2 | Mn(OH)2 | CuS | MnS | MnCO3 |
| 沉淀完全时的PH | 3.7 | 5.2 | 6.4 | 9.8 | ≥0 | ≥7 | ≥7 |
| 1 |
| 2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com