
加碘食盐中通常加入的是KIO3,该物质在酸性条件下表现出较强的氧化性,可以和碘化物、亚硫酸盐等还原性物质发生反应。
(1)写出KIO3与KI在稀硫酸介质中发生反应的离子方程式______________________
(2)为测定菜加碘盐中碘元素的含量,某学生甲设计了如下实验:
A.准确称取wg食盐,使其完全溶解在适量的蒸馏水中;
B.用稀硫酸酸化所得溶液,加入过量的KI溶液,使其充分反应;
C.以___________________为指示剂,运滴加入物质的量浓度为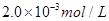 的硫代硫酸钠溶液10.0mL,恰好完全反应,判断反应完全的实验现象为____________________________________,则该加碘盐样品中碘元素的含量为______________________mg/Kg(用含w的代数式表示)。
的硫代硫酸钠溶液10.0mL,恰好完全反应,判断反应完全的实验现象为____________________________________,则该加碘盐样品中碘元素的含量为______________________mg/Kg(用含w的代数式表示)。
(已知: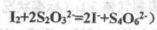 )
)
(3)某学生乙又进行了下列实验:
A.准确称取1.0g纯净的NaCl,加3mL蒸馏水配成溶液,溶液为无色;
B.滴入5滴指示剂和1mL 0.lmol/L Kl溶液,充分振荡,溶液不变化;
C.继续滴加l滴1mol/L的硫酸溶液,充分振荡,溶液变蓝色
推测实验中产生蓝色现象的原因,用离子方程式表示________________________
根据学生乙的实验结果,请对学生甲的实验结果进行分________________________(偏大、偏小、正确),其原因是________________________________________________.
⑴、IO3-+5I-+6H+=3I2+3H2O
⑵、淀粉溶液;溶液由蓝色变为无色,且三十秒内没有变化;1270/3w
⑶、4I-+4H++O2=2I2+2H2O;偏大;因为甲同学实验中加入了过量的KI,I-在稀硫酸环境中被空气中的氧气氧化生成了I2。
解析试题分析:⑴碘酸盐有强的氧化性,而碘离子有强的还原性,二都在酸性条件下可以发生氧化还原反应生成碘单质:IO3-+5I-+6H+=3I2+3H2O
⑵加碘食盐中加入硫酸和碘化钾后,形成碘单质,然后用有还原性的硫代硫酸钠来进行滴定,肯定是使用淀粉溶液来作指示剂了,因为淀粉指示剂不影响碘单质和硫代硫酸钠的用量。还能表明二者的反应刚好完全,所以判断反应完全的实验现象是:溶液由蓝色变为无色,且在三十秒内没有变化。
从以上提供的方程式中可知:
I KIO3
KIO3 3I2
3I2 6S2O32-
6S2O32-
127g 6mol
2.0×10-3mol/L×0.01L
x =2.0×10-5mol
则该加碘盐样品中碘元素的含量为:1000x×1000=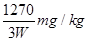
⑶因为原来加的是纯食盐,所以不含有碘酸钾,但是加入碘离子再加入酸后为什么还变色呢,肯定是有氧化剂,这个氧化剂只能是空气中的氧气。
考点:食盐中的成分以及碘元素的性质。


 冲刺100分1号卷系列答案
冲刺100分1号卷系列答案科目:高中化学 来源: 题型:填空题
写出下列化学方程式、离子方程式或电离方程式:
(1)碳酸钠溶液和过量的醋酸溶液反应(离子方程式)
(2)镁在二氧化碳气体中燃烧(化学方程式)
(3)次氯酸电离(电离方程式)
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
Ⅰ.为了除去KCl溶液中少量的Mg2+、SO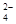 ,可选用Ba(OH)2、HCl和K2CO3三种试剂,按如下步骤操作:
,可选用Ba(OH)2、HCl和K2CO3三种试剂,按如下步骤操作: 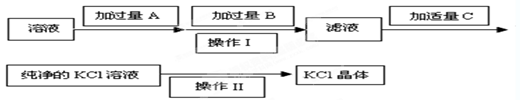
(1)上述试剂中, B是 ,C是 。
(2)操作Ⅱ的名称是 。
(3)加过量A时发生有关反应的离子方程式为 、 。
Ⅱ.一份无色稀溶液中可能含有Na+、Fe3+、H+、Mg2+、CO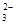 、OH-、HCO
、OH-、HCO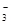 、Cl-等离子中的若干种。为了确定溶液的组成,进行了如下操作:
、Cl-等离子中的若干种。为了确定溶液的组成,进行了如下操作:
①用石蕊试纸测溶液的酸碱性,试纸显蓝色;
②取2毫升溶液,先加足量稀硝酸酸化,有气体产生,再加氯化钡溶液进行检验,没有明显现象;
(1)原溶液中一定存在的离子是 ,一定不存在的离子是 。
(2)经过上述操作后,还不能肯定是否存在的离子是 。请你设计一个简单的实验方案来判断是否存在这种离子。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
1L某混合溶液,可能含有的离子如下表:
| 可能大量含有的阳离子 | H+、Ag+、Mg2+、Al3+、NH4+、Fe3+ |
| 可能大量含有的阴离子 | Cl-、Br-、I-、CO32-、Al(OH)4-(或AlO2-) |

查看答案和解析>>
科目:高中化学 来源: 题型:填空题
按要求回答下列问题:
(1)生产普通玻璃的主要原料是______。
(2)PbSO4难溶于水,易溶于醋酸钠溶液,且发生复分解反应,化学方程式为:
PbSO4+2CH3COONa=Na2SO4+(CH3COO)2Pb,该反应的离子方程式为 。
(3)铁制品在潮湿的空气中易被氧化而锈蚀。以下是探究铁制品在潮湿的空气中铁元素被氧化价态的一个实验方案,请你将它补充完整(检验铁元素的价态必须使用中学化学中最灵敏的试剂):取铁锈样品,
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
分别用一种试剂将下列物质中混入的少量杂质除去(括号内为混入的杂质)
| 物质 | 需加入的试剂 | 有关离子方程式 |
| (1)HNO3(H2SO4) | | |
| (2)Cu(Fe) | | |
| (3)NaCl(Na2CO3) | | |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
在烧杯中盛有半杯的Ba(OH)2溶液,然后用滴管向烧杯中滴加H2SO4(装置如右图)。随着硫酸的滴入,电灯会逐渐变暗,当两者恰好完全反应时,电灯完全熄灭。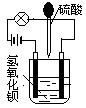
(1)该实验说明溶液的导电性与_________________有关。
(2)上述反应的离子方程式为_________________________________________。
(3)可以利用上述原理进行溶液浓度的测定。若烧杯中装有75mL 0.1mol/L Ba(OH)2溶液,当滴入25mL H2SO4时,电灯完全熄灭。试求该硫酸溶液的物质的量浓度。
(4)若用98%、1.84g/mL的浓硫酸配制上述浓度的硫酸溶液2500mL,需要多少毫升的浓硫酸(精确到0.1mL)。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
硫酸盐在生产生活中有广泛应用。
Ⅰ.工业上以重晶石(主要成分BaSO4)为原料制备BaCl2,其工艺流程示意图如下: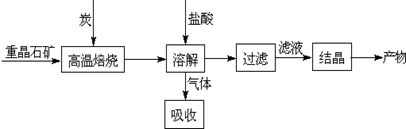
某研究小组查阅资料得:
BaSO4(s)+4C(s) 4CO(g)+BaS(s)△H1=+571.2kJ?mol-1 ①
4CO(g)+BaS(s)△H1=+571.2kJ?mol-1 ①
BaSO4(s)+2C(s) 2CO2(g)+BaS(s)△H2=+226.2kJ?mol-1 ②
2CO2(g)+BaS(s)△H2=+226.2kJ?mol-1 ②
(1)用过量NaOH溶液吸收气体,得到硫化钠。该反应的离子方程式是 。
(2)反应C(s)+CO2(g) 2CO(g)的△H= 。
2CO(g)的△H= 。
(3)实际生产中必须加入过量的炭,同时还要通入空气,其目的有两个
①从原料角度看, ;
②从能量角度看,①②为吸热反应,炭和氧气反应放热维持反应所需高温。
(4)该小组同学想对BaSO4在水中的沉淀溶解平衡做进一步研究,查资料发现在某温度时BaSO4在水中的沉淀溶解平衡曲线如图所示。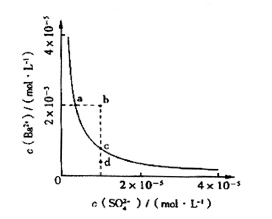
该小组同学提出以下四种观点:
①当向含有SO42-的溶液中加入Ba2+ 使SO42-沉淀完全,则此时SO42-在溶液中的浓度为0
②加入Na2SO4可以使溶液由a点变到b点
③通过蒸发可以使溶液由d点变到c点
④d点无BaSO4沉淀生成
其中正确的是 (填序号)。
Ⅱ.某燃料电池以CaHSO4固体为电解质传递H+,其基本结构如图所示,电池总反应可表示为2H2+O2═2H2O。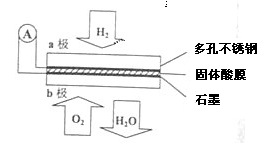
请回答:
(5)H+由 极通过固体酸电解质传递到另一极(填a或者b)。
(6)b极上发生的电极反应是 。
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
从海藻灰中可以提取碘的主要反应为:2 I-+Cl2="2" Cl-+I2,下列说法正确的是
| A.该反应属于置换反应 | B.I-具有氧化性 |
| C.1mol氯气转移了1mol电子 | D.Cl2是还原剂 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com