
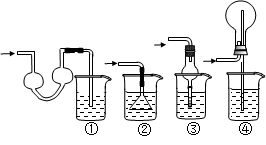


科目:高中化学 来源:不详 题型:单选题
| A.铜与浓硫酸 | B.铁与浓硫酸 |
| C.铝和氢氧化钠溶液 | D.二氧化锰和浓盐酸 |
查看答案和解析>>
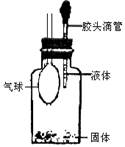
科目:高中化学 来源:不详 题型:实验题
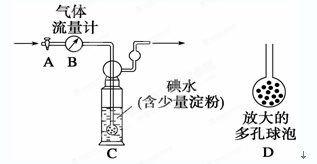
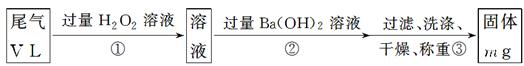
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
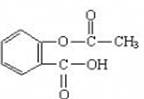
| A.该物质能与浓溴水发生取代反应 |
| B.该物质能发生酯化反应 |
| C.该物质属于蛋白质 |
| D.该物质极易溶于水和有机溶剂 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| 编号 | 实验 | 操作 |
| A | 钠与水反应 | 用镊子从煤油中取出金属钠,切下绿豆大小的钠, 小心放入装满水的烧杯中。 |
| B | 制备并检验氢气的可燃性 | 锌粒与稀硫酸反应产生气体,立即点燃。 |
| C | 用浓硫酸制稀硫酸 | 把水沿器壁倒入装有浓硫酸的烧杯中,并用玻璃 棒不断搅拌。 |
| D | 一氧化碳还原氧化铜 | 用石灰水检验气体产物,实验结束时先从水槽中 取出导管,再熄灭酒精灯。 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
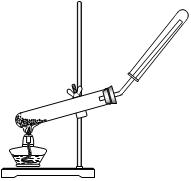
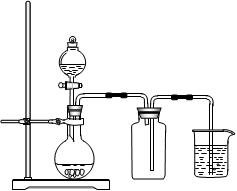
| A.用氯化铵和氢氧化钙制NH3 | B.用铜片和稀硝酸制NO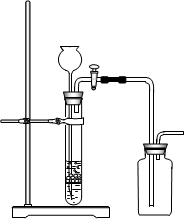 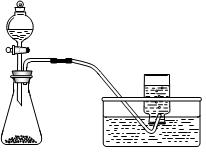 |
| C.用锌粒和稀硫酸制H2 | D.用双氧水和二氧化锰制O2 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
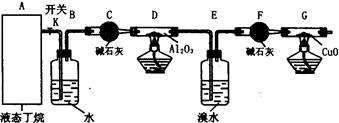
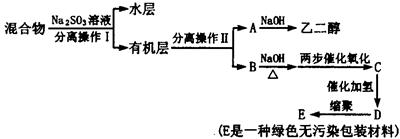
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com