
A、Mg+2RbCl
| ||||
| B、在由镁铝形成的原电池中,负极反应一定是:Mg-2e-═Mg2+ | ||||
| C、MgCl2、AlCl3溶液分别加热蒸发、灼烧,均可得到氧化镁和氧化铝 | ||||
| D、因为氧化镁和氧化铝都是高熔点的物质,所以工业上分别用电解熔融MgCl2和AlCl3的方法制取镁和铝 |


科目:高中化学 来源: 题型:
| A | B | C | D | |
| 研 究 目 的 | 固定容积的密闭容器中,压强对反应: 2SO2(g)+O2(g)?2SO3(g)的影响 | 固定容积的密闭容器中,温度对反应: N2(g)+3H2(g)?2NH3(g)△H<0的影响 | 固定容积的密闭容器中,增大CO2浓度,对已达平衡的反应: CO(g)+H2O(g)?CO2(g)+H2(g)的影响 | 等质量Na、K 分别与足量水反应 |
| 示 意 图 | 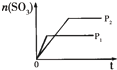 | 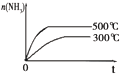 | 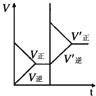 | 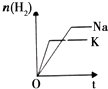 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
| c(OH-)≤10-6mol?L-1 |
| c(OH-)≥10-4mol?L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、H-CHO |
| B、C6H5OH |
| C、C6H5CH2OH |
| D、C6H5COOH |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、生成42.0LN2(标准状况) |
| B、转移电子的物质的量为1.25mol |
| C、有0.250molKNO3被氧化 |
| D、被氧化的N原子的物质的量为1.875mol |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、3.0mol/L |
| B、1.5 mol/L |
| C、2.0 mol/L |
| D、1.0mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、容器内压强 |
| B、平均相对分子质量 |
| C、各成分含量 |
| D、混合气体颜色 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com