
| A | B | C | D | |
| 研 究 目 的 | 固定容积的密闭容器中,压强对反应: 2SO2(g)+O2(g)?2SO3(g)的影响 | 固定容积的密闭容器中,温度对反应: N2(g)+3H2(g)?2NH3(g)△H<0的影响 | 固定容积的密闭容器中,增大CO2浓度,对已达平衡的反应: CO(g)+H2O(g)?CO2(g)+H2(g)的影响 | 等质量Na、K 分别与足量水反应 |
| 示 意 图 | 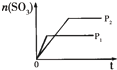 | 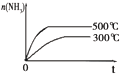 | 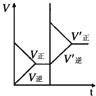 | 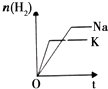 |
| A、A | B、B | C、C | D、D |


科目:高中化学 来源: 题型:
 开发新型储氢材料是氢能利用的重要研究方向.
开发新型储氢材料是氢能利用的重要研究方向.查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、由于某一条件的改变,使平衡混合物中各组分的浓度发生了不同程度的改变 |
| B、有气态物质参加的可逆反应达到平衡后,改变了压强 |
| C、化学反应速率发生了改变 |
| D、可逆反应达到平衡后,使用催化剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 容器 | 起始各物质的物质的量/mol | 达到平衡时体系 能量的变化 | |||
| SO2 | O2 | SO3 | Ar | ||
| 甲 | 2 | 1 | 0 | 0 | 放出热量:Q1 |
| 乙 | 1.8 | 0.9 | 0.2 | 0 | 放出热量:Q2 |
| 丙 | 1.8 | 0.9 | 0.2 | 0.1 | 放出热量:Q3 |
| A、Q1=Q2=Q3=197kJ |
| B、若在上述条件下反应生成2mol SO3(s)的反应热为△H1,则△H1>-197kJ?mol-1 |
| C、甲、乙、丙3个容器中反应的平衡常数不相等 |
| D、达到平衡时,丙容器中SO2的体积分数最小 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、0.4mol |
| B、0.6mol |
| C、0.4<x<0.6mol |
| D、x>0.6mol |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、Mg+2RbCl
| ||||
| B、在由镁铝形成的原电池中,负极反应一定是:Mg-2e-═Mg2+ | ||||
| C、MgCl2、AlCl3溶液分别加热蒸发、灼烧,均可得到氧化镁和氧化铝 | ||||
| D、因为氧化镁和氧化铝都是高熔点的物质,所以工业上分别用电解熔融MgCl2和AlCl3的方法制取镁和铝 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com