
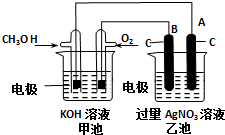
 某实验小组依据甲醇燃烧的反应原理,设计如图所示的装置.已知甲池的总反应式为:2CH3OH+3O2+4KOH=2K2CO3+6H2O.请回答:
某实验小组依据甲醇燃烧的反应原理,设计如图所示的装置.已知甲池的总反应式为:2CH3OH+3O2+4KOH=2K2CO3+6H2O.请回答:

科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
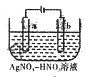 金属冶炼与处理常涉及氧化还原反应
金属冶炼与处理常涉及氧化还原反应查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 在一容积为2L的密闭容器中,加入0.2mol的N2和0.6mol的H2,在一定条件下发生反应:N2(g)+3H2(g)?2NH3(g)△H<0
在一容积为2L的密闭容器中,加入0.2mol的N2和0.6mol的H2,在一定条件下发生反应:N2(g)+3H2(g)?2NH3(g)△H<0查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Fe<Zn<Mg |
| B、Zn<Fe<Mg |
| C、Fe<Mg<Zn |
| D、Zn<Mg<Fe |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com