
����Ŀ�������¶��£����ܵ���ʵı�����Һ�д��ڳ����ܽ�ƽ�⣬��֪��
���� | Fe(OH)2 | Cu(OH)2 | Fe(OH)3 |
KSP(25��) | 8.0��10-16 | 2.2��10-20 | 4.0��10-38 |
25��ʱ������CuSO4��FeSO4��Fe2(SO4)3��0.5mol��1L�����Һ�������ϱ����ݶϣ�����˵������ȷ���ǣ� ��
A. ������Һ�м���������ˮ��������pH��3��4����ˣ��ɻ�ô�����CuSO4��Һ
B. ������Һ����μ���NaOH��Һ�����ȿ������ɫ����
C. ����Һ��c(SO42-)��[c(Cu2��)+ c(Fe2��)+c(Fe3��)]��5��4
D. ��pH=5����Һ�У�Fe3�����ܴ�������
���𰸡�A
��������A. ���ɿ�����(NH4)2SO4�����ܻ�ô�����CuSO4��Һ����A����ȷ��B. ������Һ����μ���NaOH��Һ����ʼ����Fe(OH)3ʱpH��С���������ȿ������ɫ��������B��ȷ��C. ����Һ��c(SO42-)=2.5mol/L������Cu2����Fe2����Fe3������ˮ�ⷴӦ��ʹ��c(Cu2��)+c(Fe2��)+c(Fe3��)<2.0mol/L����ˣ�c(SO42-)��[c(Cu2��)+ c(Fe2��)+c(Fe3��)]��5��4����C��ȷ��D. ��pH=5����Һ��c(OH��)=1��10-9mol/L��Fe3������ȫ����ʱ��c(Fe3��)��1��10-5mol/L��c(OH��)��(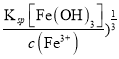 =(
=(![]() <1��10-9mol/L��������pH=5����Һ�У�Fe3�����ܴ������ڣ���D��ȷ����ѡA��
<1��10-9mol/L��������pH=5����Һ�У�Fe3�����ܴ������ڣ���D��ȷ����ѡA��


 ��������һ���þ�ϵ�д�
��������һ���þ�ϵ�д� Сѧ��10����Ӧ����ϵ�д�
Сѧ��10����Ӧ����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����������ʷ���ȫ����ȷ���ǣ� ��
�ٴ��� ��ʳ��ˮ ��ʯ��ˮ ��NaOH ��Һ̬�� ��KClO3 ��
A.��٢�
B.������ۢܢ�
C.�٢�
D.�����ڢ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������������Ԫ��X��Y��Z��R��T��ԭ�Ӱ뾶��ԭ�������Ĺ�ϵ��ͼ��ʾ��Y��Z���γ�Z2Y��Z2Y2�����ӻ�����Rԭ�������������ǵ��Ӳ�����2����Z��T�γɵĻ�����Z2T���ƻ�ˮ�ĵ���ƽ�⡣����˵����ȷ����

A. ���⻯������ȶ��ԣ�R>Y
B. �����ӵİ뾶��Y>Z
C. ����������Ӧˮ��������ԣ�R>T
D. Y��T����ͬһ���塢��X����ͬһ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����һ���¶��£�������X������Y��0.32mol����10L�����ܱ������У�������Ӧx(g)+ Y(g) ![]() 2Z(g)AH<0��һ��ʱ���ﵽƽ�⡣��Ӧ�����вⶨ���������±���
2Z(g)AH<0��һ��ʱ���ﵽƽ�⡣��Ӧ�����вⶨ���������±���
t/min | 2 | 4 | 7 | 9 |
n(Y)/mol | 0.24 | 0.22 | 0.20 | 0.20 |
����˵����ȷ������ ��
A. ��Ӧǰ2min ��ƽ������ v(Z)=4.0��10-3mol/(L��min)
B. �����������䣬�����¶ȣ���Ӧ�ﵽ��ƽ��ǰv������>v������
C. ���¶��´˷�Ӧ��ƽ�ⳣ��k=1.44
D. �����������䣬�ٳ���0.2molZ��ƽ��ʱX�����������С
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪:N2O4(g)![]() 2NO2(g)����װ��N2O4��NO2����������ƿ������ˮ�У���ƿ�ڻ���������ɫ������н��۲���˵���÷�Ӧ�Ѿ��ﵽ��ѧƽ��״̬����
2NO2(g)����װ��N2O4��NO2����������ƿ������ˮ�У���ƿ�ڻ���������ɫ������н��۲���˵���÷�Ӧ�Ѿ��ﵽ��ѧƽ��״̬����
A. ��ƿ��������������ٱ仯
B. ��ƿ���������ɫ���ٱ仯
C. ��ƿ�������ѹǿ���ٱ仯
D. N2O4������������NO2����������֮��Ϊ1:2
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��CaH2����Ϊ�������������Ԫ�سʩ�1�ۣ��仯ѧ����ʽΪCaH2+2H2O�TCa��OH��2+2H2��������ˮ�ǣ� ��
A.��ԭ��
B.������
C.���ǻ�ԭ������������
D.�Ȳ����������ֲ��ǻ�ԭ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ڢ�A����A��Ԫ�ؼ��仯����������������й㷺Ӧ�á��ش��������⣺
(1)��̬��ԭ�Ӻ�������Ų�ʽΪ_______����A��Ԫ�صĻ�̬ԭ�Ӽ۲����������ͼΪ_______��
(2)H2�����й���ص���ʽ��________( ����)��
A��s-s B��s-p C��p-p
��H2F+��Ϊ�ȵ�����ķ�����________( ��һ�ּ���)��
(3)OF2��O2F2�Ƿ����OF2 ���ӵ�����ԭ���ӻ�������________���ȵĺ�����ͨʽ��ʾΪHClOx,��ij���ȵĺ����������������幹��Ϊ�����Σ���x=________��
(4)��������ʵ��۵���ԭ��������������ͣ���±�ص��ʵ��۵�,�е���ԭ���������������,��ԭ����________________________________��
(5)�ơ��ؾ�����ͼA��ʾ����ѻ���ʽ��________��



(6)�⻯�ƾ�����ͼB��ʾ(�������H+���������Na+),ͼC���⻯�ƾ����Ľ���ͼ��
��֪NA���������ӵ�������ֵ�������ܶ�Ϊdg��cm-3��
���⻯�ƾ����������ӵ���λ��Ϊ________��
��Na+�뾶Ϊ________pm(ֻ�г�����ʽ����)��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������ʽ���һ��ȡ����,���ɵIJ���ֻ��2�ֵ���
A.(CH3)2CHCH(CH3)2
B.(CH3)3CCH2CH3
C.(CH3CH2)2CHCH3
D.(CH3)4C
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com