

| ||
| ||


 教材全解字词句篇系列答案
教材全解字词句篇系列答案科目:高中化学 来源: 题型:
| A、用醋酸除去水垢:2CH3COOH+CO32-═2CH3COO-+H2O+CO2↑ |
| B、稀硝酸中加入过量的铁屑:3Fe+8H++2NO3-=3Fe3++2NO↑+4H2O |
| C、铝与氢氧化钠溶液反应:A1+2OH-═A1O2-+H2-↑ |
| D、等物质的量的KHSO4和Ba(OH)2的溶液混合:H++SO42-+Ba2++OH-=BaSO4↓+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、水玻璃和石英的主要成份都是SiO2 |
| B、Al和Cu都是用还原法从它们的矿石中冶炼出来 |
| C、氧化铝陶瓷和氮化硅陶瓷都属于高温结构陶瓷 |
| D、常温下浓硫酸和浓硝酸都可贮存在铁制容器中 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
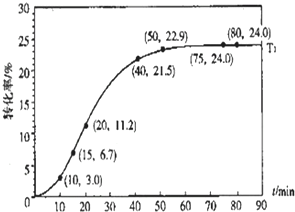 某种甲酸酯水解反应方程式为:
某种甲酸酯水解反应方程式为:| 组分 | HCOOR | H2O | HCOOH | ROH |
| 物质的量浓度/mol?L一1’ | 1.00 | 1.99 | 0.01 | 0.52 |
| 反应时间/min | 0~5 | 10~15 | 20~25 | 30~35 | 40~45 | 50~55 | 75~80 |
| 平均速率/10-3mol?L-1?min-1 | 1.9 | 7.4 | 7.8 | 4.4 | 1.6 | 0.8 | 0.0 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com