
【题目】某碳酸钠样品中可能含有少量的硫酸钠和氯化钠。某学生为检验其成分,按照如图所示步骤进行实验,请将相关内容填入相应横线处。________、________、________、________、________、________。
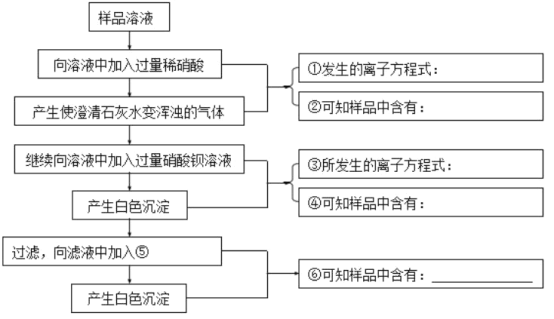
【答案】2H++CO32-=H2O+CO2↑ 碳酸钠(或Na2CO3) SO42-+Ba2+=BaSO4↓ 硫酸钠(或Na2SO4) 硝酸银溶液 氯化钠(或NaCl)
【解析】
假设样品中含有Na2CO3、NaCl、Na2SO4,则该题目的分析思路如下表所示:
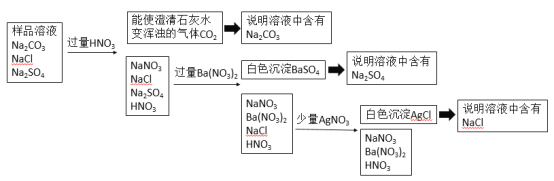
假设样品中含有Na2CO3、NaCl、Na2SO4,
①由题可知,样品溶液中一定含有Na2CO3,故加入过量的HNO3,发生反应CO32-+2H+=H2O+CO2↑;
②产生的气体能使澄清石灰水变浑浊,则该气体为为CO2,来自于Na2CO3和HNO3的反应,从而说明样品中含有Na2CO3;
③加入过量HNO3后,溶液中剩余NaCl、NaNO3、Na2SO4、HNO3,加入过量Ba(NO3)2后产生白色沉淀BaSO4,方程式为:SO42-+Ba2+=BaSO4↓;
④白色沉淀BaSO4说明样品中含有Na2SO4,因为只有Na2SO4会和Ba(NO3)2反应;
⑤加入过量Ba(NO3)2后,溶液中有NaCl、NaNO3、Ba(NO3)2、HNO3,需要加入AgNO3溶液才能产生白色沉淀,因为硝酸盐都溶于水,只能有Cl-形成沉淀;
⑥加入AgNO3后产生白色沉淀AgCl,说明样品中含有NaCl。


 探究与巩固河南科学技术出版社系列答案
探究与巩固河南科学技术出版社系列答案科目:高中化学 来源: 题型:
【题目】下列实验不能达到实验目的的是
A | B | C | D | |
实验 |
|
|
|
|
实验目的 | 实验室制取氨气 | 证明乙炔可使溴水褪色 | 检验蔗糖的水解产物具有还原性 | 证明溶解度: |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】降温结晶是分离硝酸钾和氯化钠混合物的常用方法。现取硝酸钾和氯化钠混合物160g,放入100mL水中,加热到80℃,固体全部溶解。请根据硝酸钾和氯化钠的溶解度曲线判断,下列说法正确的是( )

A.80℃时,溶液是硝酸钾和氯化钠的饱和溶液
B.80℃时,溶液中硝酸钾不饱和,氯化钠饱和
C.降温到20℃时,析出的固体一定是硝酸钾和氯化钠的混合物
D.降温到20℃时,一定析出硝酸钾,可能析出氯化钠
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】图1和图2是A、B两种物质的核磁共振氢谱。请根据图1和图2两种物质的核磁共振氢谱谱图选择出可能属于图1和图2的两种物质的分子式( )
图1 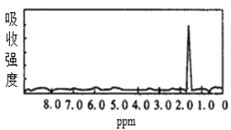 图2
图2 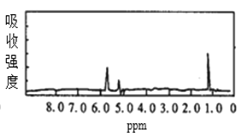
A.A是C3H6、B是C2H6B.A是C6H6、B是C4H6
C.A是C6H6、B是C2H6D.A是C3H8、B是C6H6
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示三种物质均是从巴旦杏中提取出的有香味的有机物,下列说法正确的是
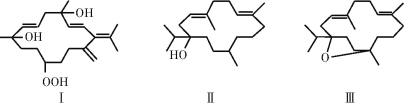
A.Ⅰ、Ⅱ、Ⅲ互为同分异构体
B.Ⅰ、Ⅱ、Ⅲ均可使酸性高锰酸钾溶液褪色
C.Ⅱ、Ⅲ分别与H2反应,均最多可以消耗2 mol H2
D.Ⅰ、Ⅱ、Ⅲ中只有Ⅲ是苯的同系物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物J 是我国自主成功研发的一类新药,它属于酯类,分子中除苯环外还含有一个五元环。合成J的一种路线如下:
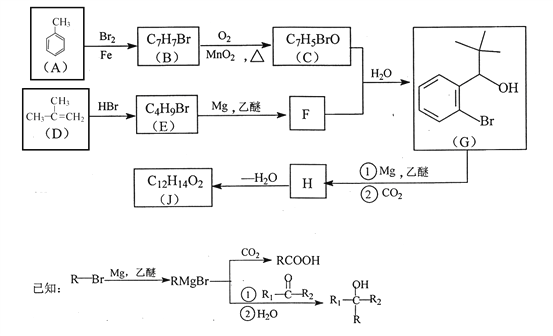
回答下列问题:
(1)B的结构简式是________________。C的结构简式是______________。
(2)D生成 E的化学方程式为_________________。
(3)J的结构简式是________________。在一定条件下,H自身缩聚生成高分子化合物的结构简式是_______________。
(4)根据![]() ,X的分子式为______。X有多种同分异构体,其中满足下列条件的同分异构体共有______种(已知:碳碳叁键或碳碳双键不能与羟基直接相连)。
,X的分子式为______。X有多种同分异构体,其中满足下列条件的同分异构体共有______种(已知:碳碳叁键或碳碳双键不能与羟基直接相连)。
A.除苯环外无其他环,且无一O—O—键
B.能与FeCl3溶液发生显色反应
C.苯环上一氯代物只有两种
(5)利用题中信息和所学知识,写出以甲烷和甲苯 为原料,合成![]() 的路线流程图(其它试剂自选):____________________________。
的路线流程图(其它试剂自选):____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列依据热化学方程式得出的结论正确的是
A.已知2C(s)+2O2(g)=2CO2(g) ΔH=a kJ·mol-1,2C(s)+O2(g)=2CO(g) ΔH=b kJ·mol-1,则a>b
B.已知NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(l) ΔH= -57.3 kJ·mol-1,则含1mol NaOH的稀溶液与足量稀醋酸完全中和,放出的热量等于57.3kJ
C.已知P(白磷,s)=P(红磷,s) ΔH<0,则白磷比红磷稳定
D.已知H2(g)+I2(g)![]() 2HI(g) ΔH= -a kJ·mol-1向密闭容器中加入2mol H2和2mol I2(g),充分反应后放出的热量小于2a kJ
2HI(g) ΔH= -a kJ·mol-1向密闭容器中加入2mol H2和2mol I2(g),充分反应后放出的热量小于2a kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究性学习小组设计了一组实验来探究第ⅦA族元素原子的得电子能力强弱规律。下图中A、B、C是三个可供选择制取氯气的装置,装置D的玻璃管中①②③④处依次放置蘸有NaBr溶液、淀粉碘化钾溶液、NaOH浓溶液和品红溶液的棉球。

(1)写出装置B中指定仪器的名称a________,b_________。
(2)实验室制取氯气还可采用如下原理:2KMnO4+16HCl(浓)===2KCl+2MnCl2+5Cl2↑+8H2O。依据该原理需要选择A、B、C装置中的________装置制取氯气。
(3)反应装置的导气管连接装置D的________(填“X”或“Y”)导管,试回答下列问题
①处所发生反应的离子方程式:____________________;
②处的现象:____________________;
③处所发生反应的离子方程式:__________________________。
(4)装置D中④的作用是__________________。
(5)某同学根据①②两处棉球颜色的变化得出结论:Cl、Br、I原子的得电子能力依次减弱。上述实验现象________(填“能”或“不能”)证明该结论、理由是___________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com