
【题目】浓度均为0.10 mol·L-1、体积均为V0的MOH和ROH溶液,分别加水稀释至体积V,pH随lg![]() 的变化如图所示。下列叙述正确的是
的变化如图所示。下列叙述正确的是
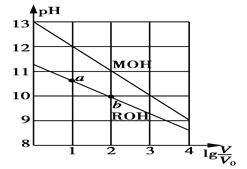
A. MOH为弱碱,ROH为强碱
B. ROH的电离程度:a点大于b点
C. 若两溶液无限稀释,则它们的c(OH-)相等
D. 当lg![]() =2时,若两溶液同时升高温度,则
=2时,若两溶液同时升高温度,则![]() 增大
增大
科目:高中化学 来源: 题型:
【题目】已知草酸晶体(H2C2O4·XH2O)可溶于水,并可与酸性高锰酸钾溶液完全反应:2KMnO4+5H2C2O4+3H2SO4==K2SO4+2MnSO4+10CO2↑+8H2O。现用氧化还原滴定法测定草酸晶体的结晶水分子数X,步骤如下:
①用分析天平称取草酸晶体1.260g,将其配制成100.00mL待测草酸溶液
②用移液管移取25.00mL待测草酸溶液于锥形瓶中,并加入适量硫酸酸化
③用浓度为0.1000mol/L的KMnO4标准溶液进行滴定,三次结果如下:
第一次滴定 | 第二次滴定 | 第三次滴定 | |
待测溶液体积(mL) | 25.00 | 25.00 | 25.00 |
标准溶液体积(mL) | 9.99 | 10.01 | 10.00 |
已知H2C2O4的相对分子质量为90,请回答下列问题:
(1)滴定时,KMnO4标准溶液应该装在________(填酸式或碱式)滴定管中。
(2)在整个实验过程中,不需要的仪器或用品是______(填序号)。
①100mL容量瓶②烧杯③滴定管夹④漏斗⑤玻璃棒⑥托盘天平
(3)到达滴定终点的标志是____________________________________________。
(4)根据上述数据计算X=________________。
(5)误差分析(填偏高、偏低或无影响):
①若滴定开始时仰视滴定管刻度,滴定结束时俯视滴定管刻度,则X值________;
②若KMnO4标准溶液浓度偏低,则X值_________;
③若锥形瓶洗净后瓶内还残留有少量蒸馏水,则X值____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,在恒容密闭容器中,能表示反应X(g)+2Y(g) ![]() 2Z(g)一定达到化学平衡状态的是( )
2Z(g)一定达到化学平衡状态的是( )
①X、Y、Z的物质的量之比为1∶2∶2
②X、Y、Z的浓度不再发生变化
③容器中的压强不再发生变化
④单位时间内生成n mol Z,同时生成2n mol Y
A. ①② B. ①④ C. ②③ D. ③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对下列现象或事实的解释不正确的是
现象或事实 | 解释 | |
A | CO2 气体缓缓通入包裹有 Na2O2 粉末的棉花,棉花很快燃烧起来 | Na2O2 与 CO2 反应放出热量 |
B | 将 Na2O2、Na2O 分别溶于水,再往其中滴入酚酞,最终溶液均变红色 | Na2O2、Na2O 都是碱性氧化物 |
C | Na 投入水中会熔成光亮的小球 | Na 与水反应放热且钠的熔点低 |
D | 工业上常用钠冶炼金属钛: | Na 具有强还原性 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学概念相互间存在如下 3 种关系,下列说法不正确的是

A. 电解质与酸、碱、盐属于包含关系
B. 化合物与氧化物属于包含关系
C. 碱性氧化物与酸性氧化物属于并列关系
D. 复分解反应与氧化还原反应属于交叉关系
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用NA表示阿伏加德罗常数的值,下列说法正确的是
A. 在1 L0.1 mol/L的硫化钠溶液中,阴离子总数大于0.1NA
B. 常温常压下,Na2O2与足量H2O反应,生成4.48LO2,转移电子的数目为0.2NA
C. 在密闭容器中充入1.5 mol H2和0.5 mol N2,充分反应后可得到NH3的分子数为NA
D. 电解精炼铜的过程中,电路中每通过NA个电子,阳极溶解铜32g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种生活中常用的纯碱溶液浓度为 0.5 mol/L,某同学欲用纯碱粉末配制该溶液 480 mL 备用。请回答下列相关问题:
(1)除烧杯、玻璃棒外,一定还需要用到的玻璃仪器有____________
(2)计算:需要称取纯碱固体的质量为__________ g
(3)配制时,正确的操作顺序是(每个序号只用一次)_______________
A.用少量水洗涤烧杯 2 次~3 次,洗涤液均注入容量瓶,振荡
B.在盛有纯碱固体的烧杯中加入适量水溶解
C.将恢复到室温的溶液沿玻璃棒注入容量瓶中
D.将容量瓶塞紧,上下颠倒摇匀
E.改用胶头滴管加水,使溶液凹液面恰好与刻度线相平
F.继续往容量瓶内小心加水,直到液面接近刻度 1 cm~2 cm 处
(4)下列会导致所配溶液实际浓度偏高的是____________
a.在 C 步骤中未恢复到室温即注入容量瓶
b.在 D 步骤完成后发现液面低于刻度线
c.在 E 步骤中俯视凹液面
(5)若欲用上述溶液另外配制 100 mL 0.2 mol/L 的纯碱溶液,则需取用上述溶液的体积为_________mL
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com