
【题目】利用N2和H2可以实现NH3的工业合成,而氨又可以进一步制备硝酸,在工业上一般可进行连续生产。请回答下列问题:
(1)已知:N2(g)+O2(g)=2NO(g);△H=+180.5kJ/mol
N2(g)+3H2(g)![]() 2NH3(g);△H=﹣92.4kJ/mol
2NH3(g);△H=﹣92.4kJ/mol
2H2(g)+O2(g)=2H2O(g);△H=﹣483.6kJ/mol
写出氨气经催化氧化完全生成一氧化氮气体和水蒸气的热化学方程式为。
(2)N2O5是一种新型硝化剂,其性质和制备受到人们的关注。现以H2、O2、熔融盐Na2CO3组成的燃料电池,采用电解法制备N2O5,装置如图所示,其中Y为CO2。

写出石墨I电极上发生反应的电极反应式 ;
在电解池中生成N2O5的电极反应式为 。
(3)以甲醇燃料电池为电源,用惰性电极电解饱和NaCl溶液时,每消耗0.2molCH3OH,阴极产生标况下气体的体积为 L。
【答案】
(1)4NH3(g)+5O2(g)=4NO(g)+6H2O(g)△H=﹣905.0kJ/mol;
(2)H2+CO32﹣﹣2e﹣=CO2+H2O;N2O4+2HNO3﹣2e﹣=2N2O5+2H+;
(3)13.44;
【解析】
试题分析:(1)N2(g)+O2(g)═2NO(g)△H=+180.5kJ/mol……①,N2(g)+3H2(g)═2NH3(g)△H=-92.4kJ/mol……②,2H2(g)+O2(g)═2H2O(g)△H=-483.6kJ/mol……③,由盖斯定律①×2-②×2+③×3得:4NH3(g)+5O2(g)═4NO(g)+6H2O(g)△H=905.0kJ/mol;故答案为:4NH3(g)+5O2(g)=4NO(g)+6H2O(g)△H=-905.0kJ/mol;
(2)燃料原电池中,负极上燃料失电子和碳酸根离子反应生成二氧化碳和水,电极反应式为H2+CO32--2e-=CO2+H2O;N2O5中氮元素的化合价是+5价,而硝酸中氮元素也是+5价.因此应该在左侧生成N2O5,即在阳极区域生成,据电极反应离子放电顺序可知:阴极发生2H++2e-=H2↑的反应,则阳极为N2O4+2HNO3-2e-=2N2O5+2H+.故答案为:H2+CO32--2e-=CO2+H2O;N2O4+2HNO3-2e-=2N2O5+2H+;
(3)用该电池作电源,用惰性电极电解饱和NaCl溶液时,CH3OH-6e-+8OH-=CO32-+6H2O,每消耗0.2molCH3OH,转移电子1.2mol,阴极电极反应为2H++2e-=H2↑,产生标况下气体的体积=0.6mol×22.4L/mol=13.44L;故答案为:13.44。


科目:高中化学 来源: 题型:
【题目】下列说法中,正确的是
A. 过量的Fe与Cl2反应生成FeCl2 B. 实验室可用KMnO4与盐酸反应制取Cl2
C. Cl2在H2中燃烧呈现苍白色火焰 D. 1 mol Cl2溶于水生成1 mol强酸和1mol弱酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将盛有12mLNO2和O2混合气体的量筒倒立于水槽中,充分反应后,还剩余2mL无色气体,则原混合气体中O2的体积可能是( )

A.2.1mL B.2.4mL C.3.6mL D.4mL
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碱式碳酸钴[ Cox(OH)y(CO3)2 ]常用作电子材料,磁性材料的添加剂,受热时可分解生成三种氧化物。为了确定其组成,某化学兴趣小组同学设计了如图所示进行实验。
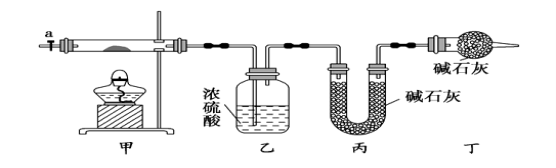
⑴请完成下列实验步骤:
①称取3.65g样品置于硬质玻璃管内,称量乙、丙装置的质量;
②按如图所示装置组装好仪器,并检验装置气密性;
③加热甲中玻璃管,当乙装置中___________(填实验现象),停止加热;
④打开活塞a,缓缓通入空气数分钟后,称量乙、丙装置的质量;
⑤计算。
⑵步骤④中缓缓通入空气数分钟的目的是__________________。
⑶某同学认为上述实验装置中存在一个明显缺陷,为解决这一问题,可选用下列装置中的_____ _(填字母)连接在_____ ____(填装置连接位置)。

⑷若按正确装置进行实验,测得如下数据:
乙装置的质量/g | 丙装置的质量/g | |
加热前 | 80.00 | 62.00 |
加热后 | 80.36 | 62.88 |
则该碱式碳酸钴的化学式为____________________。
⑸CoCl2·6H2O常用作多彩水泥的添加剂,以含钴废料(含少量Fe、Al等杂质)制取CoCl2·6H2O的一种工艺如下:

已知:
沉淀物 | Fe(OH)3 | Fe(OH)2 | Co(OH)2 | Al(OH)3 |
开始沉淀(PH) | 2.3 | 7.5 | 7.6 | 3.4 |
完全沉淀(PH) | 4.1 | 9.7 | 9.2 | 5.2 |
①净除杂质时,加入H2O2 发生反应的离子方程式为______________________。
②加入CoCO3调PH为5.2~7.6,则操作Ⅰ获得的滤渣成分为__________________。
③加盐酸调整PH为2~3的目的为____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子在指定溶液中一定能大量共存的是
A.能使甲基橙变红的溶液中:Fe2+、Al3+、NO![]() 、Cl-
、Cl-
B.在pH=12的溶液中:Na+、AlO![]() 、NO
、NO![]() 、S2-
、S2-
C.室温下,由水电离的c(H+)=10-10mol/L的溶液中:Cl-、HCO![]() 、NO
、NO![]() 、NH
、NH![]()
D.加入Mg能放出H2的溶液中:Mg2+、NH![]() 、ClO-、K+
、ClO-、K+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2017年3月28 日,中国成功开采可燃冰,主要成分为甲烷,属于一次能源。下列不属于 一次能源的是( )
A. 石油 B. 风能 C. 太阳能 D. 氢能
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列变化规律的叙述中,正确的是( )
A.F﹣、Cl﹣、Br﹣、I﹣的还原性逐渐减弱
B.NaOH、KOH、RbOH的碱性逐渐减弱
C.Li、Na、K、Rb、Cs的金属性逐渐减弱
D.HF、HCl、HBr、HI的稳定性逐渐减弱
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A. 可以利用溴水区分裂化汽油和直馏汽油
B. 煤的气化是指高温下煤与水蒸汽反应生成CO、CH4、H2、焦炉气的过程
C. 乙烯、苯均能与H2发生加成反应,说明二者均含碳碳双键
D. 相同质量的乙炔、苯分别在足量的氧气中燃烧,苯比乙炔消耗的氧气质量多
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是元素周期表的一部分(1~36号元素),试回答下列问题:

(1)D的元素符号是_______;H代表的元素在周期表中的位置是________。
(2)F、G、I、K、M对应的简单离子的半径由大到小的顺序是________(用离子符号表示)。
(3)请写出MY2的电子式:______。
(4)常温常压下,上表中的元素对应的单质为有色且是气态的有_________。
(5)X的非金属性_____于J(填“强”或“弱”),请用化学方程式证明上述结论______。
(6)元素B和L形成的化合物的水溶液与元素K的单质反应的离子方程式为_________,反应后,向溶液中加人X、K形成的化合物溶液,现象为:____________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com