
【题目】在一定温度下,某饱和氢氧化钠溶液体积为V mL,溶液密度为d g·cm-3,质量分数为w,物质的量浓度为c mol·L-1,溶液中含氢氧化钠的质量为m g,该温度下NaOH的溶解度为S。
(1)用w来表示该温度下氢氧化钠的溶解度(S)为_________________。
(2)用m、V表示溶液中溶质的物质的量浓度(c)为__________________。
(3)用w、d表示溶液中溶质的物质的量浓度(c)为__________________。
(4)用c、d表示溶液中溶质的质量分数(w)为______________________。
(5)用S、d表示溶液中溶质的物质的量浓度(c)为___________________。
科目:高中化学 来源: 题型:
【题目】下列关于溶液的酸碱性说法正确的是( )
A.c(H+)很小的溶液一定呈碱性B.pH = 7的溶液一定呈中性
C.c(H+)=c(OH-)的溶液一定呈中性D.不能使酚酞试液变红的溶液一定呈碱性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃和1.01×105Pa时,反应2N2O5(g)=4NO2(g)+O2(g) △H=+56.7kJ/mol,自发进行的原因是( )
A. 是吸热反应 B. 是放热反应
C. 是熵减少的反应 D. 熵增大效应大于能量效应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海水是一个巨大的化学资源宝库.利用海水可以获得许许多多化工产品。
(1)由海水经过晾硒可制得粗盐.实验室去除掉粗盐中的泥沙所需的玻璃仪器有_________________。
(2)利用制盐后的盐卤提取溴的工艺流程如下(部分操作和条件已略去):

①溶液I→Br2的离子方程式为:Br-+BrO3-+H+→Br2+H2O(未配平),反应中氧化产物和还原产物的质量之比为____________。
②上图中低浓度尽Br2加Na2CO3,、H2SO4处理的目的是____________。
(3)盐卤蒸发冷却后析出卤块的主要成分是MgCl2此外还含Fe2+、Fe3+、Mn2+等离子,以卤块为原料制得镁的工艺流程如下(部分操作和条件巳略去)

巳知生成氢氧化物沉淀的pH如下.
沉淀物 | Fe(OH)2 | Fe(OH)3 | Mn(OH)2 | Mg(OH)2 |
开始沉淀 | 7.6 | 2.7 | 8.3 | 9.6 |
沉淀完全 | 9.6 | 3.7 | 9.8 | 11.1 |
①步骤②中需控制pH=9.8,其目的是____________________________________。
②NaClO还能除去盐卤中的尿素[CO (NH2)2],生成盐类物质和能参与大气循环的物质,其反应原理___________(用化学方程式表示),请你计算,若除去盐卤中含有的0.1 molCO (NH2)2时需消耗NaClO_____g。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】节日期间因燃放鞭炮会引起空气中SO2含量增高.造成大气污染。某实验小组同学欲探究SO2的性质,并测定空气中SO2的含量
(1)他们设计如下实验装置,请你参与探究并回答问题
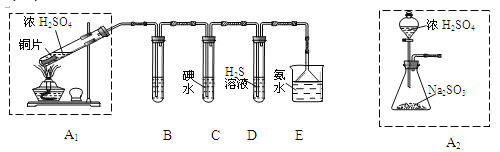
①装置A1中发生反应的化学方程式为________________________。
②装置B用于检验SO2的漂白性,其中所盛试剂为_________,装置D中实验现象为_______________。
③装置C中反应的离子方程式为___________________________________。
④为了实现绿色环保的目标。 甲同学欲用装置A2代替装置A1,你认为装置A2的优点是(写两点)________________________________________________________________。
(2)他们拟用以下方法测定空气中SO2含量(假设空气中无其他还原性气体)
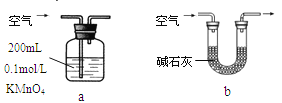
你认为哪个装置可行(填序号)__________,使用你所选用的装置测定SO2含量时,还需要测定的物理量是______________________________;不可行的请说明理由___________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】
常见的太阳能电池有单晶硅太阳能电池、多晶硅太阳能电池、GaAs太阳能电池及铜铟镓硒薄膜太阳能电池等。
(1)Cu+在基态时的价电子排布式为______。
(2)砷、碲是第四周期的相邻元素,已知砷的第一电离能大于硒。请从原子结构的角度加以解释______。
(3)GaAs熔点1238℃,难溶于溶剂。其晶体类型为_________。
(4)AsF3的空间构型是:______________。
(5)硼酸(H3BO3)本身不能电离出H+,在水中易结合一个OH-生成[B(OH)4]-,而体现弱酸性。
①[B(OH)4]-中B原子的杂化类型为______。
②[B(OH)4]-的结构式为____________。
(6)金刚石的晶胞如下图,若以硅原子代替金刚石晶体中的碳原子,便得到晶体硅:若将金刚石晶体中一半的碳原子換成硅原子,且碳、硅原子交替,即得到碳化硅晶体(金刚砂)。
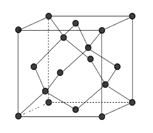
①金刚石、晶体硅、碳化硅的熔点由高到低的排列顺序是_______(用化学式表示)。
②立方氮化硼晶体的结构与金刚石相似,硬度与金刚石相当,晶胞边长为361.5pm。立方氮化硼的密度是___________g·㎝-3(B的相对原子质量为11,只要求列算式,不必计算出数值,阿伏伽徳罗常数为NA)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种新型的乙醇电池,它用磺酸类质子溶剂.电池总反应为:C2H5OH+3O2→2CO2+3H2O,电池示意如图,下列说法正确的是

A. a极为电池的正极
B. 电池工作时电流由a极沿导线经灯泡再到b极
C. 电池负极的电极反应为:4H++O2+4e-=2H2O
D. 电池工作时,1mol乙醇被氧化时就有12mol电子转移
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于Na2CO3和NaHCO3性质的说法不正确的是
A.热稳定性:NaHCO3<Na2CO3
B.与同浓度盐酸反应的剧烈程度:NaHCO3<Na2CO3
C. 相同温度时,在水中的溶解性:NaHCO3<Na2CO3
D. 等物质的量的Na2CO3、NaHCO3分别与足量盐酸反应产生的CO2质量相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】肼(N2H4)是火箭燃料,常温下为液体,其分子的球棍模型如下图所示。肼能与双氧水发生反应:N2H4+ 2H2O2=== N2+ 4H2O。下列说法正确的是()

A. 标准状况下,3.2 g N2H4的体积是2.24L
B. 标准状况下,11.2 L N2中含电子总数约为7×6.02×1023
C. 标准状况下,22.4 L H2O2中所含原子总数约为4×6.02×1023
D. 若生成3.6 g H2O,则上述反应转移电子的数目约为2×6.02×1023
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com