
【化学—物质结构与性质】
碳是形成化合物种类最多的元素。
(1)C、N、O三种元素的第一电离能由大到小的顺序为______,碳的最简单气态氢化物中心原子的杂化类型为___________。
(2)类肉素[(SCN)2]的结构式为N C—S—S—C
C—S—S—C N。其分子中
N。其分子中 键和
键和 键的个数比为__________;该物质对应的酸有两种,理论上硫氰酸(H—S—C
键的个数比为__________;该物质对应的酸有两种,理论上硫氰酸(H—S—C N)的沸点低于异硫氰酸(H—N=C=S)的沸点,其原因是___________________。
N)的沸点低于异硫氰酸(H—N=C=S)的沸点,其原因是___________________。
(3)位于第四周期VIII族,其基态原子的未成对电子数与基态碳原子的未成对电子数相同的元素,其基态原子的价层电子排布式为 ____________。
(4)碳化硅的结构与金刚石类似,其硬度仅次于金刚石,具有较强的耐磨性能,其晶胞结构如图所示(其中·为碳原子,○为硅原子)。每个碳原子周围与其距离最近的硅原子有_____个;设晶胞边长为a cm,密度为b g·cm-3,则阿伏加德罗常数可表示为__________(用含a、b的式子表示).

(1)N>O>C,sp3;(2)5:4,异硫氰酸分子间形成氢键而硫氰酸分子间不能形成氢键;(3)3d84s2;(4)4,160/(a3×b)。
【解析】
试题分析:(1)第一电离能的规律:同周期从左向右第一电离能增大,但是ⅡA>ⅢA,ⅤA>ⅥA,因此N>O>C,碳的最简单气态氢化物为CH4,根据甲烷的结构简式,中心原子为C有4个δ键,无孤对电子,价层电子对数4,即sp3杂化;(2)两个原子成键只能生成1个δ键,单键只有δ键,双键有1个δ键1个π键,叁键有1个δ键2个π键,该分子中有5个δ键,4个π键,比值为5:4,沸点高低判断:①结构相似,看相对分子质量,相对分子质量越大,范德华力越大,熔沸点越高;②有分子间氢键的沸点高,形成氢键的条件:a.必须有氢,且氢与电负性大半径小的原子(N、O、F)形成共价键,b.吸引氢形成氢键的原子要电负性大且半径小(N、O、F),异硫氰酸具有形成氢键的条件,有分子间氢键的物质它的熔沸点比没有分子间氢键的物质高,原因:异硫氰酸分子间可形成氢键,而硫氰酸分子间不能;(3)基态碳原子位于周期表第二周期ⅣA族元素,其未成对电子数2,第四周期Ⅷ族元素最后一个电子落在了3d轨道上,也有2个未成对电子,该元素是Ni,价电子排布是3d84s2;(4)根据晶胞结构,每个碳原子周围与其距离 最近的硅原子有4个,结构中含有的碳原子的个数8×1/8+6×1/2=4,SiC的物质的量为4/NAmol,根据ρ=m/v=4×40/(NA×a3),整理解得:NA=160/(a3×b)。
考点:考查第一电离能、杂化类型、δ和π键、晶胞等相关知识。
考点分析: 考点1:物质的结构与性质 试题属性

科目:高中化学 来源:2014-2015学年山东省枣庄市高三下学期开学初检测试卷理综化学试卷(解析版) 题型:实验题
(19分)根据侯德榜提出的工艺,制碱厂设计生产流程如下:

(1)该流程中可循环利用的物质是 。向母液中通氨气,并加入细小食盐颗粒,冷却析出副产品,通氨气的作用有 。
A.增大NH4+的浓度,使NH4Cl更多地析出
B.使NaHCO3更多地析出
C.使NaHCO3转化为Na2CO3,提高析出的NH4Cl纯度
(2)检验产品纯碱中是否含有NaCl的试剂是 。
(3)某学习小组在实验室模拟制碱有关工艺。
①若利用氯化铵和熟石灰制取氨气,反应方程式是 ,制得的氨气可用下列盛有NaCl溶液的 装置吸收。

②已知用饱和NaNO2与NH4C1溶液加热可制取氮气。该小组模拟工业合成氨设计如下装置:
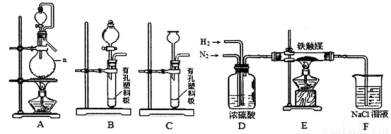
仪器a的名称是 ;氢气的发生装置应选用 ;A装置加热片刻后,即应移去酒精灯以防反应物冲出,其原因是 。装置D的作用是①除去N2、H2中的水;② ;③观察并调节气泡速率,控制N2、H2的比例。
有同学认为:从氨合成器(E装置)中出来的气体连续通入F装置的NaCl溶液中,可能会发生倒吸。你认为是否可能并说明理由 。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年山东省烟台市高三下学期一模诊断测试理科综合化学试卷(解析版) 题型:填空题
(12分)【化学—化学与技术】
铝生产产业链由铝土矿开采、氧化铝制取、铝的冶炼和铝材加工等环节构成。

(1)工业上采用电解氧化铝和冰晶石(Na3AlF6)熔融体的方法冶炼得到金属铝:2Al2O3 4Al+3O2↑。
4Al+3O2↑。
加入冰晶石的作用为_______________________。
(2)上述工艺所得铝材中往往含有少量Fe和Si等杂质,可用电解方法进一步提纯,该电解池中阳极的电极反应式为________,下列可作阴极材料的是______。
a.铝材 b.石墨 c.铅板 d.纯铝
(3)阳极氧化能使金属表面生成致密的氧化膜。以稀硫酸为电解液,铝阳极发生的电极反应式_______________________。在铝阳极氧化过程中,需要不断地调整电压,理由是_________________。
(4)下列说法正确的是__________________。
a.阳极氧化是应用原电池原理进行金属材料表面处理的技术
b.铝的阳极氧化可增强铝表面的绝缘性能
c.铝的阳极氧化可提高金属铝及其合金的耐腐蚀性,但耐磨性下降
d.铝的阳极氧化膜富多孔性,具有很强的吸附性能,能吸附染料而呈各种颜色
查看答案和解析>>
科目:高中化学 来源:2014-2015学年山东省泰安市高三下学期一模理科综合化学试卷(解析版) 题型:选择题
向20 mL 0.1 mol·L-1氨水中逐滴加入0.1mol·L-1稀HCl,混合液pH与所加盐酸体积(V/mL)的关系如图所示。下列说法正确的是

A.在D点:c(NH4+)+c(NH3·H2O)>c(Cl-)
B.在C点,有V1>10,且c(NH4+)=c(Cl-)>c(OH-)=c(H+)
C.在A、C间任一点,溶液中一定都有:c(NH4+)>c(Cl-)>c(OH-)>c(H+)
D.由B到C的过程中,c(NH4+)/c(NH3·H2O)先增大后减小
查看答案和解析>>
科目:高中化学 来源:2014-2015学年湖北省稳派教育高三一轮复习质量检测理科综合化学试卷(解析版) 题型:填空题
【化学-选修5:有机化学基础】(15分)
共轭双烯与含有双键的化合物相互作用,能生成六元环状化合物。
已知反应①:
化合物Ⅱ可发生以下反应:

(1)化合物Ⅰ的分子式为_______。 1 mol该物质完全燃烧需消耗_______ molO2。
(2)反应②的化学方程式为______________
(3)反应③是缩聚反应,化合物Ⅳ的结构简式为_______

(4)在一定条件下,化合物Ⅴ和化合物Ⅵ能发生类似反应①的反应,生 成两种化合物(互为同分异构体),其结构简式分别为________、______
(5)下列关于化合物Ⅰ、Ⅱ、Ⅴ、Ⅵ的说法正确的有_______ (填字母)。
A.Ⅰ属于芳香烃
B.Ⅰ、Ⅱ、Ⅴ均能使溴的四氯化碳溶液褪色
C.Ⅴ与足量H2加成后的产物是3—甲基戊烷
D.加热条件下Ⅵ能与新制Cu (OH)2反应生成红色沉淀
查看答案和解析>>
科目:高中化学 来源:2014-2015学年广东省中山市高三下学期第二次模拟考试理科综合化学试卷(解析版) 题型:选择题
下列叙述不正确的是
A.铁表面镀锌,铁作阳极
B.船底镶嵌锌块,锌作负极,以防船体被腐蚀
C.钢铁吸氧腐蚀的正极反应:O2 +2H2O+4e-=4OH—
D.工业上电解饱和食盐水的阴极反应:2Cl一 一2e一=C12↑
查看答案和解析>>
科目:高中化学 来源:2014-2015学年江西省六校高三3月联考化学试卷(解析版) 题型:选择题
已知某有机物X的结构简式如图所示,下列有关叙述不正确的是

A.X的化学式为C10H10O6
B.X在一定条件下能与FeCl3溶液发生显色反应
C.1 mol X分别与足量的Na、NaOH溶液、NaHCO3溶液反应,消耗这三种物质的物质的量分别为3 mol、4 mol、1 mol
D.X在一定条件下能发生消去反应和酯化反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com