
| A、标况下,11.2L的CHCl3含有分子数为0.5NA个 |
| B、常温下,14g乙烯和丙烯的混合物中总原子数为3NA个 |
| C、1mol苯乙烯中含有的碳碳双键数为4NA个 |
| D、0.1mol CnH2n+2中含有的碳碳单键数为0.1nNA个 |


科目:高中化学 来源: 题型:
| 元素 | 结构及性质 |
| A | A的原子半径最小 |
| X | X原子最外层电子数是次外层的两倍 |
| D | D是短周期中金属性最强的元素 |
| E | E的最高价氧化物对应水化物是一种常见的两性氢氧化物 |
| R | R与X同主族 |
| T | T的负一价阴离子的核外电子排布与Ar原子相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 如图是部分短周期元素化合价与原子序数的关系图,下列说法正确的是( )
如图是部分短周期元素化合价与原子序数的关系图,下列说法正确的是( )| A、R和Z形成的化合物属于共价化合物 |
| B、Y单质能在X的单质中燃烧,生成淡黄色物质Y2X2 |
| C、X、Z形成的化合物化学式为Z2X3,它属碱性氧化物 |
| D、在常温下,Z单质能溶于W的最高价氧化物对应水化物浓溶液中,生成氢气 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 1 |
| 2 |
| A、由X、Y、Z、M四种元素形成的化合物一定有共价键 |
| B、原子半径:W>Z>Y>X>M |
| C、由X元素形成的单质一定是原子晶体 |
| D、XZ2、X2M2、W2Z2均为直线型的共价化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、氯化铵固体与消石灰反应制备氨气:NH4++OH-=NH3↑+H2O | ||||
B、用石墨棒作电极电解饱和食盐水:Cl-+Na+
| ||||
| C、硫酸铝溶液与过量氨水反应的离子方程式:Al3++3NH3?H2O=Al(OH)3↓+3NH4+ | ||||
| D、用稀硝酸洗涤试管内壁的银镜:Ag+2H++NO3-=Ag++NO↑+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、元素X与氢形成原子个数比为1:1的化合物有多种 |
| B、元素Y的单质与氢氧化钠溶液或盐酸反应均有氢气生成 |
| C、Z的原子半径比Y的原子半径大 |
| D、元素Z可与元素X形成共价化合物XZ2,且各微粒均满足8电子的稳定结构 |
查看答案和解析>>
科目:高中化学 来源: 题型:

| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
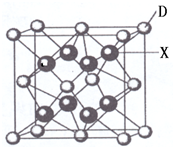 已知A、B、C、D、E都是周期表中前四周期的元素,它们的核电荷数A<B<C<D<E.其中A、B、C是同一周期的非金属元素.化合物DC2的晶体为离子晶体,其阳离子与阴离子的个数比为1:1,D的二价阳离子比C的简单阴离子多一个电子层.AC2为非极性分子.B、C的氢化物的沸点比它们同族相邻周期元素氢化物的沸点高.E原子序数为26.回答下列问题:(答题时,A、B、C、D、E用所对应的元素符号表示).
已知A、B、C、D、E都是周期表中前四周期的元素,它们的核电荷数A<B<C<D<E.其中A、B、C是同一周期的非金属元素.化合物DC2的晶体为离子晶体,其阳离子与阴离子的个数比为1:1,D的二价阳离子比C的简单阴离子多一个电子层.AC2为非极性分子.B、C的氢化物的沸点比它们同族相邻周期元素氢化物的沸点高.E原子序数为26.回答下列问题:(答题时,A、B、C、D、E用所对应的元素符号表示).查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com