
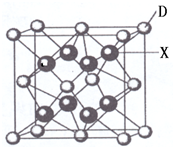
 已知A、B、C、D、E都是周期表中前四周期的元素,它们的核电荷数A<B<C<D<E.其中A、B、C是同一周期的非金属元素.化合物DC2的晶体为离子晶体,其阳离子与阴离子的个数比为1:1,D的二价阳离子比C的简单阴离子多一个电子层.AC2为非极性分子.B、C的氢化物的沸点比它们同族相邻周期元素氢化物的沸点高.E原子序数为26.回答下列问题:(答题时,A、B、C、D、E用所对应的元素符号表示).
已知A、B、C、D、E都是周期表中前四周期的元素,它们的核电荷数A<B<C<D<E.其中A、B、C是同一周期的非金属元素.化合物DC2的晶体为离子晶体,其阳离子与阴离子的个数比为1:1,D的二价阳离子比C的简单阴离子多一个电子层.AC2为非极性分子.B、C的氢化物的沸点比它们同族相邻周期元素氢化物的沸点高.E原子序数为26.回答下列问题:(答题时,A、B、C、D、E用所对应的元素符号表示).| 4+2-2×3 |
| 2 |
| 1 |
| 2 |
| 1 |
| 8 |


科目:高中化学 来源: 题型:
| A、标况下,11.2L的CHCl3含有分子数为0.5NA个 |
| B、常温下,14g乙烯和丙烯的混合物中总原子数为3NA个 |
| C、1mol苯乙烯中含有的碳碳双键数为4NA个 |
| D、0.1mol CnH2n+2中含有的碳碳单键数为0.1nNA个 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 ,NO2中氮氧键的键能为466kJ?mol-1,N2O4中N-N键键能为167kJ?mol-1,氮氧键的键能为438.5kJ?mol-1,写出N2O4转化为NO2的热化学方程式
,NO2中氮氧键的键能为466kJ?mol-1,N2O4中N-N键键能为167kJ?mol-1,氮氧键的键能为438.5kJ?mol-1,写出N2O4转化为NO2的热化学方程式| 充电 |
| 放电 |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 已知2NO2(g)═N2O4(g)△H=-52.7kJ?mol-1,常温下NO2为红棕色气体,N2O4为无色气体.某课外活动小组为了探究温度和压强对化学平衡的影响,做如下(1)(2)两个实验:
已知2NO2(g)═N2O4(g)△H=-52.7kJ?mol-1,常温下NO2为红棕色气体,N2O4为无色气体.某课外活动小组为了探究温度和压强对化学平衡的影响,做如下(1)(2)两个实验:查看答案和解析>>
科目:高中化学 来源: 题型:
 如图所示反应I、Ⅱ、Ⅲ均是工业生产中常见的反应.其中A、B为化合物,C是温室气体之一,D和J均可用做干燥剂,常温下,H为无色液体,E、F为气体.
如图所示反应I、Ⅱ、Ⅲ均是工业生产中常见的反应.其中A、B为化合物,C是温室气体之一,D和J均可用做干燥剂,常温下,H为无色液体,E、F为气体.查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| A、常温常压下,32g O2中含有的氧分子个数为2NA |
| B、2.4g金属镁与足量的盐酸反应,转移的电子数为2NA |
| C、分子数为NA的CO气体质量为28g |
| D、0.1mol/L 稀硫酸中含有H+个数为0.1NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com