
 已知2NO2(g)═N2O4(g)△H=-52.7kJ?mol-1,常温下NO2为红棕色气体,N2O4为无色气体.某课外活动小组为了探究温度和压强对化学平衡的影响,做如下(1)(2)两个实验:
已知2NO2(g)═N2O4(g)△H=-52.7kJ?mol-1,常温下NO2为红棕色气体,N2O4为无色气体.某课外活动小组为了探究温度和压强对化学平衡的影响,做如下(1)(2)两个实验:| c(N2O4) |
| c2(NO2) |


科目:高中化学 来源: 题型:
| A、氯化铵固体与消石灰反应制备氨气:NH4++OH-=NH3↑+H2O | ||||
B、用石墨棒作电极电解饱和食盐水:Cl-+Na+
| ||||
| C、硫酸铝溶液与过量氨水反应的离子方程式:Al3++3NH3?H2O=Al(OH)3↓+3NH4+ | ||||
| D、用稀硝酸洗涤试管内壁的银镜:Ag+2H++NO3-=Ag++NO↑+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
 某混合溶液中可能大量含有的离子如下表所示:
某混合溶液中可能大量含有的离子如下表所示:| 阳离子 | H+、K+、Al3+、NH4+、Mg2+ |
| 阴离子 | Cl-、Br-、OH-、CO32-、AlO2- |
查看答案和解析>>
科目:高中化学 来源: 题型:
 甲醇-空气燃料电池(DMFC)是一种高效能、轻污染的车载电池,该电池利用质子交换膜传导H+,电池总反应为:2CH3OH+3O2=2CO2(g)+4H2O某化学兴趣小组同学研究甲醇-空气燃料电池原理,并进一步进行电化学实验,其实验装置示意图如图.
甲醇-空气燃料电池(DMFC)是一种高效能、轻污染的车载电池,该电池利用质子交换膜传导H+,电池总反应为:2CH3OH+3O2=2CO2(g)+4H2O某化学兴趣小组同学研究甲醇-空气燃料电池原理,并进一步进行电化学实验,其实验装置示意图如图.查看答案和解析>>
科目:高中化学 来源: 题型:
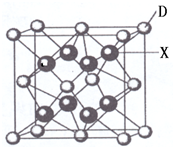 已知A、B、C、D、E都是周期表中前四周期的元素,它们的核电荷数A<B<C<D<E.其中A、B、C是同一周期的非金属元素.化合物DC2的晶体为离子晶体,其阳离子与阴离子的个数比为1:1,D的二价阳离子比C的简单阴离子多一个电子层.AC2为非极性分子.B、C的氢化物的沸点比它们同族相邻周期元素氢化物的沸点高.E原子序数为26.回答下列问题:(答题时,A、B、C、D、E用所对应的元素符号表示).
已知A、B、C、D、E都是周期表中前四周期的元素,它们的核电荷数A<B<C<D<E.其中A、B、C是同一周期的非金属元素.化合物DC2的晶体为离子晶体,其阳离子与阴离子的个数比为1:1,D的二价阳离子比C的简单阴离子多一个电子层.AC2为非极性分子.B、C的氢化物的沸点比它们同族相邻周期元素氢化物的沸点高.E原子序数为26.回答下列问题:(答题时,A、B、C、D、E用所对应的元素符号表示).查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 阳离子 | Ag+ Na+ |
| 阴离子 | NO3- SO42- Cl- |

查看答案和解析>>
科目:高中化学 来源: 题型:
| A、-770 kJ/mol |
| B、-l220 kJ/mol |
| C、-1500kJ/mol |
| D、-2740kJ/mol |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Cl- | ||
B、HCO
| ||
| C、Na+ | ||
D、NO
|
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com